I biosimilari come strumento di razionalizzazione della spesa
Le tematiche legate all’utilizzo dei biosimilari, che presentano costi di trattamento inferiori rispetto ai biologici originatori, sono al giorno d’oggi di primaria importanza all’interno di una sempre maggiore necessità di razionalizzazione della spesa sanitaria.
Tuttavia, le opportunità fornite dai biosimilari, in termini di risparmi e sostenibilità del SSN, devono essere conciliate con le esigenze di medici e pazienti riguardo gli aspetti clinici del trattamento, quali l’appropriatezza terapeutica e le indicazioni prescrittive. L’Agenzia Europea dei Farmaci (European Medicines Agency – EMA) definisce un biosimilare come «un farmaco biologico che è simile a un altro farmaco biologico che ha già ottenuto l’autorizzazione», pertanto, la scelta di prescrivere il biosimilare, invece del farmaco biologico di riferimento, rappresenta un’opportunità per migliorare l’accesso ai farmaci biologici e razionalizzare il consumo di risorse mantenendo un elevato profilo di efficacia e sicurezza.
I biosimilari possono giocare un ruolo importante nell’attuale scenario di contenimento della spesa, non solo migliorando l’accesso ai farmaci biologici a un maggior numero di pazienti, ma anche promuovendo la sostenibilità finanziaria dei servizi sanitari. L’ingresso sul mercato dei biosimilari genera infatti competizione con il biologico originatore, con conseguente riduzione dei costi di trattamento, e i risparmi associati all’utilizzo dei biosimilari possono essere riallocati per finanziare nuovi farmaci.
Aspetti regolatori
I biosimilari vengono autorizzati dall’EMA attraverso procedura centralizzata, pertanto l’autorizzazione è valida in tutti gli Stati membri. Permangono, tuttavia, significative differenze tra gli Stati Europei in termini di penetrazione del mercato, policy di pricing e rimborso, intercambiabilità e sostituibilità tra biosimilari e originatore. L’EMA lascia infatti alle autorità locali l’eventuale sostituibilità dei biosimilari, specificando che la scelta di prescrivere un biologico piuttosto che un altro deve essere presa da personale sanitario qualificato. In Italia l’AIFA afferma che, sebbene i biosimilari siano opzioni terapeutiche con lo stesso rapporto rischio-beneficio degli originatori, non possono essere considerati come veri e propri generici e l’eventuale switch da un farmaco biologico a un altro non deve essere automatica, ma rimane affidata al giudizio clinico. In assenza di linee guida nazionali, le Regioni italiane hanno emanato diverse direttive e decreti al fine di incoraggiare l’utilizzo dei biosimilari, rendendo di fatto lo scenario prescrittivo poco omogeneo.
Il mercato dei biosimilari
Le scadenze brevettuali dei primi farmaci biologici hanno portato negli ultimi anni a una notevole espansione del mercato dei biosimilari: dall’autorizzazione del primo biosimilare (somatropina) nell’aprile 2006, l’EMA ha infatti autorizzato 21 nuovi prodotti, con indicazioni sia nella terapia di supporto che nel trattamento di patologie croniche, inoltre nel gennaio 2017 5 nuove molecole hanno ricevuto parere positivo dal Committee for Medicinal Products for Human Use (CHMP) dell’EMA e 14 applicazioni sono al vaglio della commissione. È stato stimato che entro il 2018 i farmaci biologici/biotecnologici rappresenteranno circa il 49% dell’intero mercato farmaceutico ed entro il 2020 le scadenze brevettuali consentiranno ai biosimilari di entrare sul mercato di Francia, Germania, Spagna, Italia e UK al posto di farmaci biologici (adalimumab, insulina glargine, etanercept, infliximab, rituximab, peg-filgrastim, trastuzumab, alfa-follitropina) che fatturano oltre 40 miliardi di Euro (Figura 1).
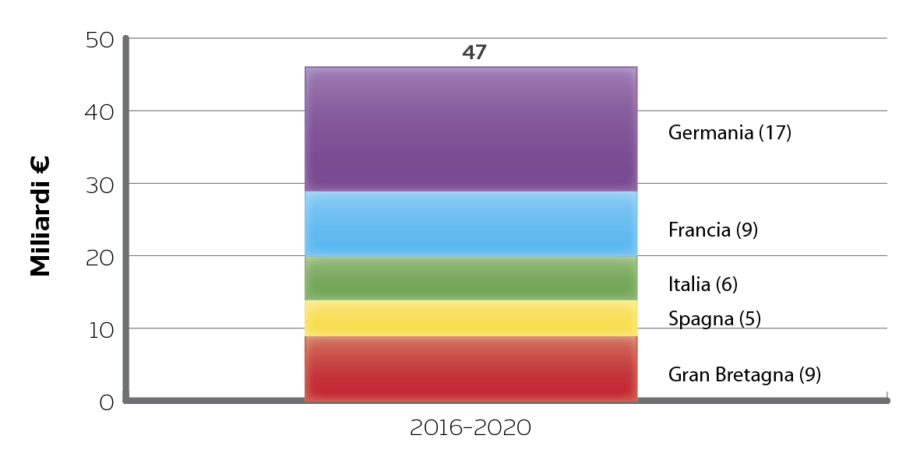
Figura 1. Mercato potenziale dei biosimilari
Fonte: IMS Health, MIDAS; IMS Health Market Prognosis; IMS Institute for Healthcare Informatics, Dec 2015
I biosimilari entrano sul mercato a un prezzo inferiore rispetto a quello dell’originatore, innescando meccanismi di competitività che portano a una riduzione dei costi. È stato infatti stimato che il costo giornaliero di trattamento con gli originatori, che hanno già perso o perderanno il brevetto entro il 2018 (adalimumab, insulina glargine, etanercept, infliximab, rituximab, peg-filgrastim, trastuzumab, alfa-follitropina), potrebbe portare entro il 2020 a risparmi complessivi che variano dai 49 ai 98 miliardi di Euro (Figura 2).
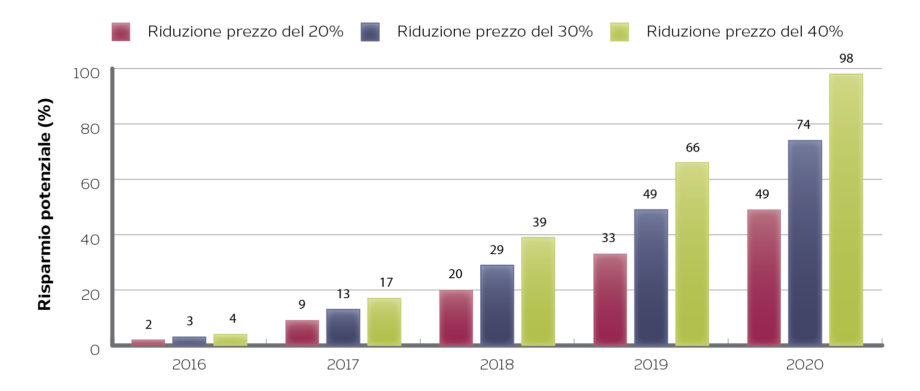
Figura 2. Risparmi potenziali derivanti dalla riduzione del costo di trattamento di 8 originatori (adalimumab, insulina glargine, etanercept, infliximab, rituximab, peg-filgrastim, trastuzumab, alfa-follitropina) a causa della competizione con i biosimilari in Francia, Germania, Spagna, Italia, UK e USA
Fonte: IMS Health, MIDAS, IMS Health Market Prognosis; IMS Institute for Healthcare Informatics, Dec 2015
Gain-sharing: l’esperienza italiana
Tra le direttive Regionali, emanate in Italia per incentivare l’utilizzo dei biosimilari, l’elemento di novità è stato introdotto in Regione Campania, nella quale, per favorire il raggiungimento di obiettivi di spesa regionali, è previsto un incentivo economico in caso di risparmio derivante dall’utilizzo di biologici meno costosi.
Il decreto della Regione Campania rappresenta il primo esempio nazionale di gain-sharing
Il decreto della Regione Campania rappresenta il primo esempio nazionale di gain-sharing, una forma di iniziativa pay-for-performance che si distingue dal shared saving in quanto unisce il risparmio ottenuto con il miglioramento della qualità e prevede di condividere solo i guadagni e non le perdite. Nel setting sanitario le iniziative di gain-sharing permettono alle strutture sanitarie di incoraggiare i clinici a effettuare scelte costo-efficaci aiutandoli a prendere coscienza del proprio contributo al costo totale di cura. Il gain-sharing risponde alle esigenze di aumento di efficienza dei sistemi sanitari in quanto l’obiettivo principale dell’incentivo finanziario è quello di migliorare la qualità dei servizi offerti oltre che la produttività. Inoltre, sono programmi auto-finanziati in quanto vengono utilizzate risorse economiche che la struttura sanitaria non avrebbe altrimenti a disposizione.
I programmi di gain-sharing hanno dimostrato di essere dei driver efficaci per aumentare l’uptake dei biosimilari in alcuni mercati europei, portando benefici ai prescrittori, ai decision marker e ai payer. Per quanto riguarda i clinici, il gain-sharing è risultato più efficace se il medico ha modo di vedere benefici tangibili dai risparmi generati, come per esempio servizi aggiuntivi per i pazienti, migliori condizioni di lavoro, risorse supplementari da investire. Nel caso della Regione Campania, è previsto che il 50% del risparmio ottenuto mediante l’utilizzo dei biologici a minor costo vada all’Azienda Sanitaria per l’acquisto di farmaci innovativi, mentre una quota pari al 5% della riduzione è destinata direttamente al centro prescrittore e può essere investita per migliorare la qualità dei servizi erogati e la cura dei pazienti.
Gain-sharing: l’esperienza britannica
Sebbene sia ampiamente condivisa la necessità di incrementare l’utilizzo di prodotti biosimilari, anche in virtù del sovrapponibile profilo di efficacia e sicurezza con l’originatore, sia l’AIFA che le principali società scientifiche italiane non raccomandano lo switch nei pazienti già in trattamento, incoraggiando pertanto l’utilizzo solo nei pazienti di nuova diagnosi. Un punto di vista differente arriva dal Regno Unito, dove è stato implementato un programma di switch da infliximab originatore al biosimilare che prevede, secondo accordi di gain-sharing, la distribuzione dei risparmi ottenuti tra i vari stakeholder.
Il programma è stato sviluppato nel reparto di gastroenterologia dello University Hospital Southampton NHS Foundation Trust ed è stato progettato con il supporto sia di figure sanitarie (gastroenterologi, farmacisti, infermieri specializzati) che di un panel di pazienti precedentemente trattati con farmaci biologici, al fine di raccogliere il punto di vista di tutti i soggetti coinvolti.
Il programma ha avuto inizio nell’aprile 2015 quando tutti i pazienti in trattamento con Remicade sono stati informati della possibilità di switch al biosimilare. Un infermiere specializzato ha fornito ai pazienti tutte le informazioni relative a efficacia e sicurezza dei biosimilari, illustrando i vantaggi derivanti dallo switch in termini di aumento dell’investimento di risorse in servizi a loro dedicati. Dopo due mesi 134 pazienti sono passati da infliximab originatore al biosimilare e nei primi 4 mesi è stato stimato un risparmio pari a circa 300 mila Sterline che sono state re-investite nella struttura sanitaria (ampliamento dello staff e dei supporti informatici) per migliorare l’attenzione e la cura verso i pazienti.
Il Decreto n.66 del 14.07.2016 della Regione Campania
In Regione Campania i dati di monitoraggio dell’AIFA hanno mostrato, nel periodo gennaio-dicembre 2015, uno scostamento in valore assoluto dei tetti della spesa farmaceutica territoriale e ospedaliera pari a € 174.686.914 e € 159.004.883, rispettivamente. Inoltre, dagli indicatori di appropriatezza prescrittiva monitorati nel Cruscotto Tessera Sanitaria, è stato evidenziato un potenziale risparmio per oltre 60 milioni di Euro se venissero utilizzati farmaci a brevetto scaduto e una sensibile differenza tra la spesa pro capite delle singole ASL.
Con il Decreto n.66 del 14.07.2016 il Commissario ad acta della Regione Campania ha emanato una serie di misure di incentivazione dei farmaci a brevetto scaduto e dei biosimilari al fine di stabilire obiettivi di risparmio «attraverso un miglioramento dell’appropriatezza prescrittiva, un maggior utilizzo di farmaci a brevetto scaduto e/o biosimilari di minor prezzo». Il Decreto fa riferimento alle sensibili differenze di prezzo tra biologici originatori e biosimilari e, prendendo in considerazione anche la posizione esposta dall’AIFA nel Secondo concept paper sui farmaci biosimilari, in cui i profili di efficacia e sicurezza tra il biosimilari e il biologico di riferimento vengono considerati equivalenti, decreta «che tutti i medici prescrittori debbano privilegiare nelle prescrizioni farmaceutiche, nel rispetto delle indicazioni terapeutiche autorizzate, i farmaci con brevetto scaduto, alla stessa maniera di quanto riscontrato tramite sistema Tessera Sanitaria nelle Regioni che fanno maggior uso di tali farmaci o, quantomeno, alla media delle Regioni, ferma restando la facoltà dei medici di prescrivere in scienza e coscienza».
L’obiettivo da conseguire prevede un incremento nell’utilizzo dei farmaci a brevetto scaduto e, in particolare, dei farmaci biosimilari nelle categorie ATC B03XA01 (eritropoietina), A10AE04 (insulina glargine), H01AC01 (somatropina), L03AA02 (filgrastim) L04AB01 (etanercept) e L04AB02 (infliximab) di almeno il 30% nel 2016 (rispetto a quanto rilevato nel 2015) e di un ulteriore 30% nel 2017, fino al conseguimento di un tasso di utilizzo dei farmaci biologici/biosimilari di minor costo almeno pari al tasso di rinnovo dei pazienti nel trattamento delle patologie in indicazione dei farmaci. Sempre in linea con quanto dichiarato dall’AIFA, si raccomanda l’utilizzo dei biosimilari nei pazienti di nuova diagnosi (qualora il medico prescrittore ritenga di iniziare la terapia con un farmaco a maggior costo dovrà motivare la sua scelta terapeutica), mentre nei pazienti in trattamento è garantita la continuità terapeutica, salvo diversa indicazione del medico prescrittore.
Infine, il Decreto dispone le sanzioni previste dalla normativa vigente nel caso in cui i medici prescrittori non si attengano alle disposizioni emanate e l’incentivo previsto per i centri prescrittori ed i reparti più virtuosi. Viene infatti disposto che il 50% della variazione della spesa ottenuta nel 2016 rispetto al 2015 per le categorie ATC B03XA (altri preparati antianemici), A10AE (insuline ed analoghi per iniezione ad azione lenta), H01AC (somatropina ed antagonisti della somatropina), L02AA (fattori di stimolazione delle colonie) e L04AB (inibitori del fattore di necrosi tumorale alfa) vada attribuito all’Azienda Sanitaria, in particolare: «in caso di riduzione, quale accredito da utilizzare a titolo di fondo specifico finalizzato all’acquisto di farmaci innovativi a monitoraggio dei Registri AIFA (…). Una quota pari al 5% di tale riduzione (…) va destinata direttamente al centro prescrittore, da utilizzare per potenziamento del centro stesso». In caso di aumento della spesa, la variazione viene addebitata all’Azienda Sanitaria.
Il NICE ha emanato delle linee guida per favorire l’implementazione di programmi di adozione dei biosimilari che comprendano sistemi di gain-sharing
Alla luce del successo ottenuto dal programma di switch messo in atto nell’ospedale di Southampton, il NICE (National Institute for Health and Care Excellence) ha emanato delle linee guida per favorire l’implementazione di programmi di adozione dei biosimilari che comprendano sistemi di gain-sharing per il re-investimento dei risparmi ottenuti. Le linee guida prevedono un percorso a step che ha inizio con l’individuazione delle strutture più idonee in cui attivare il programma, saranno poi le singole strutture a individuare il team di lavoro coinvolgendo uno specialista, che avrà il compito della gestione clinica del progetto, un farmacista, che gestirà l’accesso al farmaco, e un amministrativo, a cui verrà affidata la gestione dei risparmi e la definizione degli aspetti di gain-sharing. Il team così definito sarà responsabile dell’operatività del progetto, del coinvolgimento del personale medico e infermieristico e della definizione dell’obiettivo di adozione del biosimilare, compresa la quota di impiego da raggiungere rispetto all’originatore, i pazienti candidabili e le tempistiche attese per il raggiungimento. Dopo aver definito l’obiettivo, sarà necessario calcolare il risparmio atteso e definire le quote destinate ai reparti coinvolti per il miglioramento della qualità di cura. In questa fase è importante definire i bisogni prioritari di ogni reparto anche sulla base dei risparmi potenziali, al fine di pianificare attività realmente attuabili. Infine, un punto fondamentale per l’attuazione del programma è la messa a punto di indicatori da utilizzare per il monitoraggio dell’adozione del biosimilare e il contributo delle varie strutture al successo del programma.
Bibliografia di riferimento
- Regione Campania. DGR n.66 del 14.07.2016. Misure di incentivazione dei farmaci a brevetto scaduto e dei biosimilari. Monitoraggio delle prescrizioni attraverso la piattaforma Sani.ARP
- European Medicines Agency (EMA). Questions and answers on biosimilar medicines (similar biological medicinal products). EMA/837805/2011
- Agenzia Italiana del Farmaco. Secondo Concept Paper Aifa Sui Farmaci Biosimilari. AIFA, 2016
- The Institute of Health Economics (IHE). Gainsharing and shared savings strategies in the healthcare setting: Evidence for effectiveness. IHE Rapid Report, 2016 (http://www.ihe.ca/download/gainsharing_and_shared_savings_strategies_in_the_healthcare_setting_evidence_for_effectiveness.pdf)
- Aitken M. Delivering on the potential of biosimilar medicines. The role of functioning competitive markets. IMS. IMS Institute for Healthcare Informatics, 2016
- Cantelli Forti G, Rossi F. Revisione della posizione sui farmaci biosimilari da parte della Società Italiana di Farmacologia: working paper 2016. SIFO, 2016