Stato dell’arte sul contesto legislativo e il Codice degli appalti
Nella strategia “Europa 2020” gli appalti pubblici svolgono un ruolo fondamentale in quanto costituiscono uno degli strumenti del mercato necessari alla realizzazione di una crescita intelligente, sostenibile e inclusiva, e, contemporaneamente, garantiscono l’uso più efficiente possibile dei finanziamenti pubblici.
Il contesto legislativo relativo agli appalti pubblici nel quale si muovono le amministrazioni in Italia è costituito, da una parte, dalla Direttiva europea 2014/24/UE, fortemente connotata da elementi derivanti dai principi di sostenibilità sociale ed ambientale, e dall’altra dal Decreto legislativo 50/2016 (Codice degli appalti), che ha apportato modifiche importanti al settore dei contratti pubblici. In particolare, il Codice degli appalti ha incentivato l’aggregazione dei fabbisogni e della responsabilità degli affidamenti, partendo dalla programmazione per poi affrontare gli affidamenti. Nell’ottica del miglioramento dell’efficacia del procurement pubblico sono risultate particolarmente significative le disposizioni contenute nel Codice relative all’esplicita introduzione della programmazione degli appalti anche per forniture e servizi; alla considerazione del costo totale sul ciclo di vita, non solo del prezzo; all’estensione dell’applicazione del criterio dell’offerta economicamente più vantaggiosa (OEPV) per l’aggiudicazione; alla regolamentazione delle centrali di committenza e delle stazioni appaltanti, con la riduzione del numero e l’introduzione della loro qualificazione.
Nella programmazione e nell’esecuzione di un appalto pubblico, la decisione della procedura da impiegare riveste un ruolo critico e può influenzare non solo il risultato, e di conseguenza la disponibilità di un determinato bene o servizio per la comunità, ma anche il mercato, il sistema concorrenziale e i gravami derivanti dai possibili reclami o ricorsi.
Nella programmazione di un appalto pubblico, la scelta della procedura da adottare può rivestire un ruolo critico
A febbraio 2018 la Commissione Europea ha pubblicato la versione aggiornata del documento dal titolo “Orientamenti in materia di Appalti pubblici” dedicato ai professionisti che, operando nelle amministrazioni aggiudicatrici, «sono incaricati di pianificare ed effettuare l’approvvigionamento di lavori, forniture o servizi pubblici in maniera conforme alle norme, efficiente ed economicamente vantaggiosa». Di particolare interesse risulta il capitolo sulla scelta della procedura, al quale facciamo riferimento per tracciare una sintesi delle peculiarità delle procedure di gara maggiormente utilizzate nell’acquisto di farmaci, e cioè la procedura aperta, la procedura ristretta e quella negoziata senza previa pubblicazione di un bando di gara.
La procedura aperta è utilizzabile in tutte le tipologie di acquisti e si svolge in un’unica fase (selezione e valutazione). Tutti i candidati interessati possono presentare un’offerta, anche da paesi esteri. Si caratterizza per un alto livello di concorrenza, un basso rischio di reclami e un’alta trasparenza. Secondo la Commissione Europea, la percentuale di procedure aperte rappresenta un indicatore chiave del livello di concorrenza di un sistema di appalti pubblici.
Anche la procedura ristretta è utilizzabile in tutte le tipologie di acquisto; in particolare il Codice degli appalti (art. 61) la indica nel Sistema Dinamico di Acquisizione. In base alle indicazioni della Commissione Europea, può essere vantaggioso, per gli enti appaltanti, ricorrere a questa tipologia di procedura quando sono presenti sul mercato molti potenziali offerenti e risulta pertanto necessario elaborare un elenco ristretto. Infatti, questa tipologia di procedura prevede 2 fasi: durante la fase di preselezione, e a seguito della pubblicazione del bando, tutti i soggetti operanti sul mercato possono presentare una manifestazione di interesse che l’amministrazione aggiudicatrice vaglia esaminando i livelli richiesti di competenza e capacità professionale, tecnica e finanziaria, al fine di selezionare i soggetti da invitare alla gara. Data la maggiore discrezionalità in capo all’amministrazione aggiudicatrice, il rischio di corruzione o collusione è giudicato medio.
Il ricorso alla procedura negoziata senza previa pubblicazione di un bando di gara è invece possibile solo in casi particolari (urgenza, beni e servizi esclusivi o infungibili), debitamente giustificati dall’amministrazione aggiudicatrice. È prevista solo la fase di selezione e valutazione, con possibilità di limitare il numero di partecipanti fino a uno solo. Di conseguenza, è molto ridotto il livello di concorrenza, mentre aumentano notevolmente il rischio di ricorsi e quello di collusione/corruzione.
La normativa UE considera gli accordi quadro uno strumento per gli appalti aggregati e, negli orientamenti della Commissione europea, vengono consigliati «per esigenze consolidate e ripetitive, quando l’amministrazione aggiudicatrice non conosce preventivamente l’importo del contratto o non sa esattamente quando si verificherà l’esigenza rilevata».
L’accordo quadro consente un elevato grado di flessibilità in contesti con esigenze consolidate e ripetitive
L’articolo 54 del Codice degli appalti illustra le principali caratteristiche dell’accordo quadro, stabilendone la durata (massimo 4 anni per i settori ordinari e 8 anni per i settori speciali) ed evidenziando le modalità di esecuzione dell’ordine distinguendo tra due tipologie di accordo: quello concluso con un solo operatore economico e quello concluso con più operatori economici. Nel primo caso, il soggetto che si aggiudica la gara è chiamato ad eseguire il contratto entro i limiti delle condizioni fissate dall’accordo e l’amministrazione può, se necessario, chiedergli di completare la sua offerta. Nel secondo caso, l’articolo 54 specifica i termini di affidamento dell’incarico e le modalità con cui l’amministrazione può riaprire eventualmente il confronto competitivo tra gli operatori economici e richiedere una proposta migliorativa in base alla presenza o meno, nell’accordo quadro stesso, di tutti i termini che disciplinano la prestazione dei lavori, dei servizi o delle forniture.
Lo strumento dell’accordo quadro consente alle amministrazioni pubbliche di ottenere un elevato grado di flessibilità nell’affidamento ed esecuzione di appalti con caratteristiche di ripetitività e di adattabilità per gestire gli appalti di manutenzione e fornitura ordinaria.
Come noto, la Legge di Bilancio 2017 (L. 11 dicembre 2016 n. 232) ha specificato ulteriormente le modalità di ricorso all’accordo quadro, in particolare per l’acquisto di farmaci biologici a brevetto scaduto e per i quali siano presenti sul mercato i relativi farmaci biosimilari.
In Tabella I si riporta un confronto dell’accordo quadro così come definito dal Codice degli appalti e dalla Legge di Bilancio 2017.
Decreto Legislativo n. 50/2016 – Art. 54 | Legge n. 232/2016 – Art. 11 quater D.L. 95/2012 |
Comma 3-4 Le stazioni appaltanti possono concludere accordi quadro con un solo operatore economico o con più operatori economici Nel caso di più operatori secondo i termini e le condizioni dell’accordo quadro, senza riaprire il confronto competitivo, se l’accordo quadro contiene tutti i termini, nonché le condizioni oggettive per determinare quale degli operatori economici parti dell’accordo quadro effettuerà la prestazione (da indicare nei documenti di gara). L’individuazione dell’operatore economico parte dell’accordo quadro che effettuerà la prestazione avviene sulla base di decisione motivata in relazione alle specifiche esigenze dell’amministrazione | 11-Quater Per l’acquisto di farmaci biologici a brevetto scaduto e per i quali siano presenti sul mercato i relativi farmaci biosimilari, si applicano le seguenti disposizioni:
|
Comma 4 c) Riaprendo il confronto competitivo se l’accordo quadro non contiene tutti i termini che disciplinano la prestazione dei lavori, dei servizi e delle forniture |
Tabella I. L’accordo quadro nelle previsioni del Codice degli appalti (D. Lgs. n. 50/2016) e della Legge di Bilancio 2017 (Legge n. 232/2016)
I vantaggi dell’accordo quadro rispetto a forme monopolistiche di acquisto
Nel corso del 2018 abbiamo assistito ad un notevole aumento nel numero delle gare indette, da diverse amministrazioni, sia a livello regionale sia a livello nazionale, per l’acquisto di farmaci biologici. Tra le motivazioni principali di questo aumento la disponibilità sul mercato di un numero crescente di farmaci biosimilari, conseguenza della perdita di brevetto di farmaci biologici originator dall’importante impatto clinico ed economico, che ha rappresentato un’opportunità per ampliare l’accesso ai pazienti e generare risparmi sulla spesa farmaceutica pubblica.
Con la scadenza dei brevetti dei primi originator, i soggetti responsabili della stesura dei bandi di gara e dei capitolati hanno dovuto affrontare la questione della composizione dei lotti di gara. Inizialmente la decisione è stata quella di prevedere lotti separati per farmaci originator e biosimilari, che sono stati però al centro di molteplici ricorsi da parte delle case produttrici. Si è generata così una significativa giurisprudenza in merito, anche se non sempre univoca.
La composizione dei lotti di gara rimane un elemento controverso
In questo senso, importante è risultato il parere AS 1049/2013 dell’Autorità Garante della Concorrenza e del mercato che, oltre a ribadire le considerazioni già espresse in una precedente segnalazione (AS 819 del 16 marzo 2011) circa l’illegittimità nell’esclusione di un principio di equivalenza terapeutica tra le due tipologie di farmaci e la piena riconducibilità delle stesse a un unico mercato rilevante del prodotto, considera come l’eventuale previsione di esclusive di acquisto di farmaci biologici originator debba sempre risultare parametrata a criteri oggettivi (es. percentuale di pazienti già in trattamento vs. pazienti naïve) e per quanto possibile sempre assoggettabile a successive revisioni, in vista dello sviluppo di un più ampio confronto concorrenziale con i farmaci biosimilari.
Simili raccomandazioni risultano del resto in linea, da un lato, con le previsioni dell’art. 1 della Legge di Bilancio 2017 (comma 407: «Le centrali regionali d’acquisto predispongono un lotto unico per la costituzione del quale si devono considerare lo specifico principio attivo (ATC di V livello), i medesimi dosaggio e via di somministrazione»), e dall’altro con la posizione espressa in sede comunitaria, secondo cui «la disponibilità di biosimilari migliora la concorrenza e può contribuire ad ampliare la platea dei pazienti che possono accedere ai farmaci biologici, contribuendo alla sostenibilità dei sistemi sanitari europei» (Commissione UE, 2013), oltre al secondo Position Paper di AIFA del 20 aprile 2018.
Più recentemente la sentenza 627/2018 del TAR Marche, non appellata, ha accolto il ricorso contro un bando di gara che aveva previsto, per il principio attivo epoetina (classe ATC di V livello: B03XA01) non un unico lotto ma tre distinti (epoetina alfa originator, epoetina beta originator, epoetina alfa-zeta). In questo caso i giudici hanno ritenuto che non esiste differenziazione tra i lotti, trattandosi di stesso ATC, dosaggio e via di somministrazione, per cui hanno dato ragione alla società ricorrente in quanto le modalità di esecuzione dell’accordo quadro garantiscono la continuità terapeutica e non risulta pertanto necessario prevedere lotti specifici dedicati ai singoli farmaci già utilizzati dai pazienti in terapia.
Di contrario avviso, seppur per diversa implicazione, si è espressa la Sezione III del Consiglio di Stato con recente sentenza del 5 febbraio 2019, n. 871 che afferma che epoetina zeta si basa su un principio attivo “analogo” ma non identico a quello del farmaco originator, per cui sulla base della relazione di AIFA del 2 maggio 2018 i medicinali in commercio a base di epoetina alfa sono tre, ovvero un originator e due biosimilari alfa (Binocrit e Abseamed).
La classica procedura aperta o ristretta, in mancanza di lotti distinti, mal si addice ad acquisti personalizzati: infatti l’aggiudicazione è unica, spesso a livello regionale e quindi non consente al clinico di scegliere il prodotto che meglio si addice al paziente, come nel caso di diversi farmaci da somministrare.
Lo strumento che maggiormente rende fruibile l’utilizzo di prodotti diversi di una stessa tipologia merceologica è l’accordo quadro che, per le sue specifiche, presenta una serie di vantaggi e risulta ampiamente utilizzato dalle amministrazioni pubbliche, in particolare per mediare tra farmaci biologici originator e biosimilari, anche in accordo con le previsioni della Legge di Bilancio 2017.
Lo strumento che maggiormente rende fruibile l’utilizzo di prodotti diversi di una stessa tipologia merceologica è l’accordo quadro
Innanzitutto, l’accordo quadro può presentare il vantaggio di “ri-personalizzare” gli acquisti nella fase applicativa, andando a bilanciare quella “spersonalizzazione” della domanda correlata inevitabilmente alla centralizzazione della procedura e alla conseguente necessità di standardizzazione che potrebbe comportare qualche criticità in merito all’aderenza al bisogno clinico dei beni aggiudicati tramite gara.
L’accordo quadro può inoltre ritenersi flessibile per quanto riguarda i soggetti beneficiari della fornitura da esso veicolata in quanto prevede, come evidenziato dal Consiglio di Stato, sezione III, nella pronuncia n. 5489 del 21 settembre 2018, la possibilità di subire modifiche durante il periodo di efficacia dell’accordo quadro nei limiti di natura quantitativa fissati negli atti di gara. Tali modifiche, sempre secondo la pronuncia del Consiglio di Stato, possono essere quantificate con il limite del 20% del valore previsto dall’articolo 106 del Codice degli appalti.
Occorre precisare che ci si potrà attendere un ridimensionamento della portata di tale decisione a seguito della recente sentenza emessa il 19 dicembre 2018 dall’Ottava Sezione della Corte di Giustizia Europea (Causa C-216/2017) a fronte dell’ordinanza n. 1690 del 9 marzo 2017 da parte del Consiglio di Stato sui quantitativi assegnabili nell’accordo quadro. La Corte ha sancito che i principi di trasparenza e di parità di trattamento degli operatori economici interessati alla conclusione dell’accordo quadro, previsti, in particolare, dall’articolo 2 della Direttiva 2004/18, sarebbero compromessi se l’amministrazione aggiudicatrice inizialmente parte dell’accordo quadro non specificasse la quantità complessiva oggetto di un tale accordo.
Come accennato in precedenza, l’aggiudicazione di una gara tramite accordo quadro con più operatori economici consente una maggiore disponibilità di farmaci per garantire le terapie farmacologiche già in atto, salvaguardando la continuità terapeutica e le esigenze cliniche dei pazienti.
L’accordo quadro multifornitore favorisce una maggiore apertura concorrenziale
L’accordo quadro multifornitore può comportare dei vantaggi anche a livello di sistema poiché favorisce una maggiore apertura concorrenziale assicurando ai fornitori una maggiore garanzia per competere. In questo senso, la funzione concorrenziale del mercato viene massimizzata con l’ottenimento di un abbassamento dei prezzi e di una maggiore sostenibilità, anche per le terapie innovative. Può innescarsi così un ulteriore meccanismo di incentivazione che, in presenza di un mercato appetibile, stimoli un sempre maggiore interesse delle aziende nella produzione e commercializzazione dei biosimilari.
L’alto livello di concorrenza e trasparenza assicurato dall’accordo quadro può contribuire inoltre a limitare il rischio di ricorsi e reclami rispetto alla procedura di gara.
Un altro vantaggio dell’accordo quadro riguarda la limitazione del rischio di rottura di stock, a fronte del lotto unico.
Infine l’applicazione dell’accordo quadro permette di evitare la diserzione delle gare e di ridurre il numero di procedure da attivare dal momento che permette di disporre da subito di una serie di farmaci per rispondere a tutte le diverse esigenze che possono presentarsi per assicurare differenti terapie non solo nei confronti dei pazienti naïve ma di quelli già sottoposti a cura.
Dalla lettura del grafico in Figura 1 si evidenzia che l’utilizzo dell’accordo quadro risulta consigliato quando si prevede la presenza di un numero di potenziali fornitori partecipanti superiore all’unità a fronte di un grado di eterogeneità della domanda da soddisfare rivolta a pazienti destinatari di farmaci originator e biosimilari. Di conseguenza scarso risulterà l’utilizzo dell’accordo quadro in presenza di un monofornitore.
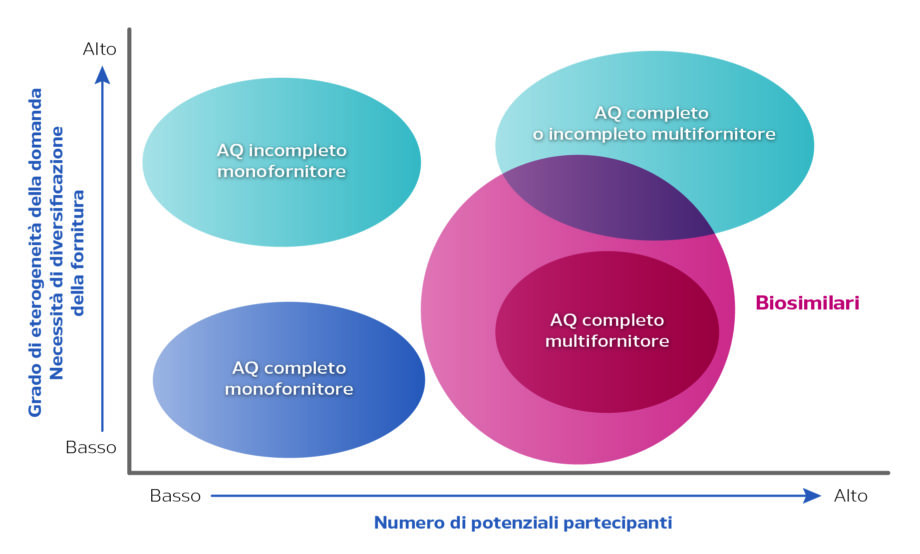
Figura 1. Accordo quadro (AQ): opzioni di scelta
Conclusioni
L’adozione dei biosimilari può avvenire solo in un ambiente che tenga conto dei bisogni di tutti gli stakeholders per garantire informazione adeguata, un sano livello di competizione e una fornitura continua.
La valorizzazione della competizione nelle gare contribuisce a creare un mercato sostenibile
Una recente indagine di Kpmg sull’acquisto di farmaci ospedalieri a brevetto scaduto in 8 paesi europei, inclusa l’Italia, ha messo in luce alcuni ostacoli per l’accesso al mercato di farmaci generici e biosimilari. In particolare, per il nostro Paese, i maggiori disincentivi sono stati identificati in: eccessiva burocratizzazione degli appalti, meccanismi di aggiudicazione troppo lunghi, alto grado di incertezza (su tempi e quantitativi di ordine), aggiudicazione al massimo ribasso. L’analisi di Kpmg è corredata inoltre da una serie di indicazioni che potrebbero contribuire a creare un sistema di mercato maggiormente sostenibile, valorizzando la competizione nelle gare: privilegiare il criterio dell’offerta economicamente più vantaggiosa rispetto al prezzo più basso, considerando anche altri elementi di valore, laddove presenti; riaprire le gare quando viene introdotto sul mercato un nuovo biosimilare o generico, anziché richiedere una riduzione del prezzo; prevedere una quantità minima e massima per lotto; alleggerire e semplificare le procedure di gara; ottimizzare il prezzo di base d’asta.
L’alto livello di concorrenza e trasparenza comporta un minore rischio di ricorsi e reclami
La presenza di un mercato maggiormente sostenibile può contribuire a garantire un elevato tasso di partecipazione alle offerte da parte delle aziende produttrici, per evitare l’aumento dei lotti deserti che si sta già verificando, a livello nazionale e internazionale, nell’ambito dei farmaci generici: secondo il rapporto Nomisma 2016 in Italia, nel periodo 2011-2015, il numero di lotti deserti nelle gare per i generici è cresciuto dal 22% al 27%, determinando una minore concorrenza nel mercato con possibili risvolti anche a livello economico. A livello internazionale, un caso importante si è verificato nel Regno Unito per un farmaco generico: nel 2017 il mercato vedeva protagoniste tre aziende competitor, mentre nel 2018 ne era rimasta una sola, a causa della cessazione della produzione da parte delle altre due; tale situazione ha comportato un aumento del prezzo a confezione da 1,59 sterline a 113,10 sterline, con un incremento di 70 volte e un esborso complessivo per il National Health Service di 315 milioni di sterline in più.
In conclusione, per creare un sistema sostenibile, l’accordo quadro appare come uno degli strumenti più efficaci per evitare derive monopolistiche o distorsive.
Bibliografia
- Commissione Europea. What you need to know about biosimilar medicinal products, Consensus Information Document. 19 aprile 2013
- Commissione Europea. Orientamenti in materia di Appalti pubblici per professionisti. Febbraio 2018
- Kpmg. Improving healthcare delivery in hospitals by optimized utilization of medicines. QuotidianoSanità, 19 ottobre 2018
- Nomisma. Il sistema dei farmaci generici in Italia. Spesa ospedaliera, effetti delle gare e sostenibilità. 2016
- House of Commons. Committee of Public Accounts. Price increases for generic medications. HC 1184. Sixty-Second Report of Session 2017-19. 12 ottobre 2018


