Intervista al dottor Michele Marangi, Ufficio Attività di Analisi e Previsione, Agenzia Italiana del Farmaco
In che cosa consiste l’attività di Horizon Scanning in AIFA e come viene implementata concretamente?
L’attività di Horizon Scanning (HS) viene definita in generale come l’identificazione sistematica di tecnologie sanitarie nuove, emergenti o obsolete e potenzialmente in grado di produrre effetti sulla salute, sui servizi sanitari e sulla società. In campo farmaceutico, in base allo specifico obiettivo, l’attività di HS può riguardare varie fasi del ciclo di vita di un medicinale. L’attività di HS dell’AIFA mira a sostenere il processo di Health Technology Assessment (HTA) interno ed è pertanto tipicamente svolta a ridosso della presentazione della domanda di autorizzazione all’immissione in commercio di un medicinale (2-3 anni prima della commercializzazione).
 Il sistema di HS dell’Agenzia prevede 3 fasi consecutive (identificazione, selezione e prioritizzazione, valutazione) alle quali si aggiungono 2 ulteriori fasi (divulgazione e integrazione nei processi decisionali delle informazioni generate, verifica periodica dei dati prodotti) con diversa periodicità (Figura 1). Per la raccolta delle informazioni vengono utilizzate diverse fonti: agenzie regolatorie, banche dati scientifiche, siti web utili allo scopo, esperti interni, registri di monitoraggio AIFA. Tutte le fasi sono sottoposte a un monitoraggio continuo mediante appropriati indicatori (Key Performance Indicators).
Il sistema di HS dell’Agenzia prevede 3 fasi consecutive (identificazione, selezione e prioritizzazione, valutazione) alle quali si aggiungono 2 ulteriori fasi (divulgazione e integrazione nei processi decisionali delle informazioni generate, verifica periodica dei dati prodotti) con diversa periodicità (Figura 1). Per la raccolta delle informazioni vengono utilizzate diverse fonti: agenzie regolatorie, banche dati scientifiche, siti web utili allo scopo, esperti interni, registri di monitoraggio AIFA. Tutte le fasi sono sottoposte a un monitoraggio continuo mediante appropriati indicatori (Key Performance Indicators).
Come vengono selezionati e valutati i farmaci che potrebbero avere un impatto clinico ed economico significativo sul Servizio Sanitario Nazionale?
Prima della selezione e della valutazione, vi è una fase di identificazione, consistente nella raccolta sistematica di informazioni relative ai nuovi medicinali in arrivo nell’arco temporale di 12-36 mesi. I medicinali identificati vengono sottoposti a dei criteri di selezione al fine di escludere alcune categorie di medicinali con impatto clinico e/o economico noto e, successivamente, a dei criteri di prioritizzazione per la valutazione del presunto impatto clinico ed economico. È bene sottolineare che tali criteri sono specifici per l’AIFA e potrebbero non essere direttamente applicabili a realtà diverse senza gli opportuni adattamenti. I criteri di prioritizzazione sono raggruppati in due domini distinti: il dominio “Impatto clinico ed economico” prende in considerazione l’impatto della malattia, il bisogno terapeutico, il valore terapeutico potenziale, l’impatto organizzativo, la stima del numero di pazienti da trattare e del costo del trattamento. In aggiunta, attraverso il dominio “Impatto regolatorio”, vengono presi in considerazione anche lo status regolatorio del medicinale (farmaco designato orfano), la tipologia degli studi clinici e l’eventuale appartenenza alla categoria dei medicinali per terapie avanzate. Per i medicinali potenzialmente più interessanti dal punto di vista scientifico viene redatto, 18-24 mesi prima della commercializzazione, un rapporto focalizzato sul valore clinico-terapeutico potenzialmente atteso che viene aggiornato man mano che si rendono disponibili nuovi dati.

Figura 1. Sistema di Horizon Scanning in AIFA
L’attività di Horizon Scanning AIFA ha una relazione con l’Early Access per le terapie avanzate e in che termini?
L’identificazione precoce di nuovi medicinali che potrebbero avere un impatto significativo sul Servizio Sanitario Nazionale (SSN), in termini di valore clinico e sostenibilità economica, offre informazioni potenzialmente utili a supportare il processo decisionale. In tale contesto, risulta pertanto importante raccogliere, in forma strutturata e con una frequenza regolare, le informazioni sui nuovi medicinali al fine di sostenere la loro adozione da parte del SSN. Come è noto, i medicinali innovativi, tra i quali le terapie avanzate, avranno un importante impatto sullo scenario futuro del SSN, essendo di interesse per la salute pubblica nonché destinati a pazienti con esigenze mediche insoddisfatte. In definitiva possiamo affermare che l’attività di HS, mirando a intercettare proprio questi medicinali, rappresenta per l’AIFA uno strumento prezioso per il SSN.
Una volta individuato un farmaco come “prioritario” è prevista una discussione preventiva con le aziende produttrici per ottimizzare e velocizzare il processo di rimborso? Se sì, chi la conduce?
Le informazioni raccolte attraverso l’attività di HS rappresentano una risorsa per l’Agenzia nella programmazione delle attività volte a rispondere ai bisogni di salute pubblica. Le aziende possono certamente contribuire al raggiungimento di questo obiettivo, ad esempio condividendo in modo trasparente informazioni complete sui risultati degli studi clinici. Tale esigenza, che risponde a quanto previsto dal Regolamento UE n. 536/2014 sulla sperimentazione clinica di medicinali per uso umano, è stata peraltro ribadita sia nella recente lettera firmata da Commissione europea (CE), Agenzia Europea per i Medicinali (EMA) e Network delle agenzie regolatorie (HMA) dei singoli Stati membri, sia nella risoluzione sulla trasparenza promossa dall’Italia presso l’Organizzazione Mondiale della Sanità (OMS).
L’obiettivo principale è identificare sistematicamente le tecnologie sanitarie nuove, emergenti o obsolete con effetti potenziali sul sistema salute
Nella vostra attività è prevista un’analisi per verificare se il SSN è pronto a ricevere i nuovi farmaci e implementarli appropriatamente (ad es. per la verifica della rimborsabilità e della disponibilità presso gli ospedali italiani degli eventuali test diagnostici di accompagnamento per i nuovi farmaci)?
Le informazioni rese disponibili con l’attività di HS consentono di supportare i processi di ricezione e implementazione nel SSN dei nuovi medicinali in arrivo. Se consideriamo ad esempio il caso delle nuove terapie oncologiche, sappiamo che le ultime scoperte e la maggiore conoscenza di alcune delle mutazioni correlate alla carcinogenesi sono alla base dell’aumento di tali terapie; tuttavia, è necessario ottimizzarne l’uso cercando, allo stesso tempo, di contenerne i costi sempre crescenti. Occorre quindi che le strutture sanitarie siano pronte a caratterizzare adeguatamente la malattia al fine di garantire l’accesso alle nuove cure a quei pazienti che ne potranno effettivamente beneficiare. Per tale motivo, fornire informazioni sui medicinali cosiddetti “target therapy” in anticipo rispetto alla loro effettiva disponibilità sul mercato italiano, offre la possibilità di programmare un’appropriata introduzione nel SSN di questi nuovi medicinali.
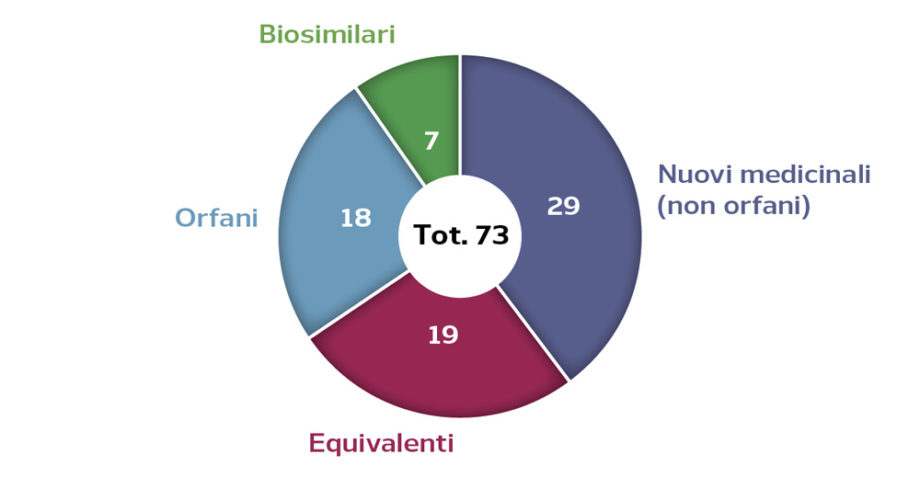
Figura 2. Medicinali previsti in valutazione presso EMA tra aprile 2019 e marzo 2020
Fonte: AIFA, Orizzonte Farmaci. Rapporto n° 1, anno 2019
Quali sono i vostri interlocutori principali (decisori, clinici, pazienti, aziende farmaceutiche)? È previsto un coordinamento della vostra attività con Agenas/ISS/Ministero della Salute e in che termini?
Gli interlocutori ai quali l’attività di HS è rivolta sono molteplici. Innanzitutto le commissioni AIFA (CTS e CPR), alle quali è possibile offrire un supporto durante il processo decisionale. In secondo luogo i cittadini, i pazienti, le associazioni e gli operatori sanitari i quali, grazie al sito istituzionale di AIFA, hanno la possibilità di acquisire informazioni sulle strategie terapeutiche potenzialmente promettenti in arrivo, nonché segnalare quelle ritenute di maggiore interesse per la salute pubblica. In tale contesto, è bene incoraggiare il dialogo con tutti gli stakeholder che a vari livelli (internazionale, nazionale, regionale e locale) si occupano della valutazione delle tecnologie sanitarie, promuovendo collaborazioni trasversali come quelle che l’AIFA intrattiene normalmente con le altre istituzioni.
Conoscere in anticipo le peculiarità delle “target therapy” consente di programmare meglio l’introduzione di questi farmaci nel SSN
È uscito recentemente il primo “Orizzonte Farmaci. Scenario dei medicinali in arrivo”: quali aspetti possono essere considerati più interessanti?
Il primo aspetto di rilievo sta nella scelta dell’AIFA di mettere a disposizione di cittadini, pazienti, associazioni, operatori sanitari e chiunque altro sia interessato un rapporto contenente informazioni su nuovi medicinali che potrebbero essere autorizzati nell’Unione Europea in un orizzonte temporale di 12 mesi. Un altro aspetto significativo è che il rapporto, utilizzando un linguaggio orientato al cittadino, dà la possibilità di contribuire attivamente all’individuazione dei medicinali a maggiore interesse per la salute pubblica che impegneranno l’Agenzia nel prossimo futuro nonché prepararsi alla loro acquisizione. Infine, tra gli aspetti più interessanti, va segnalata la possibilità per i cittadini di seguire nel tempo l’arrivo di medicinali per una data patologia attraverso gli aggiornamenti periodici.



