Nel contesto attuale, la governance farmaceutica e, più in generale, quella del Servizio Sanitario Nazionale vengono influenzate in maniera consistente dal processo degli acquisti, nel quale intervengono numerosi fattori, con diverse finalità ed esigenze: innanzitutto, le normative sugli acquisti (il Codice degli appalti e i relativi correttivi – D.Lgs. N. 50/2016, D.Lgs 56/2017, D.L. 32/2019 – e le Circolari ANAC), quelle dedicate al settore farmaceutico su tetti e tipologia di assistenza (Legge finanziaria 2019 – L. 145/2018 ), ma anche le Sentenze dei Tribunali amministrativi e le Regioni, con i vari provvedimenti di indirizzo sulle politiche farmaceutiche. Inoltre, a livello regionale sono attive la Commissione per il Prontuario Terapeutico Regionale (farmaci e dispositivi medici), la Commissione di Health Technology Assessment, la Commissione protesica), oltre alle Aziende sanitarie (USL e ospedaliere) e alle eventuali aggregazioni tra aziende sanitarie.
Il percorso degli acquisti si sviluppa in diverse fasi, di competenza del farmacista (come Direttore esecuzione del contratto) e/o del provveditore (come Responsabile unico del provvedimento – RUP), e anche congiuntamente: la determinazione dei fabbisogni qualitativi e quantitativi, la conoscenza tecnico-merceologica dei prodotti, l’applicazione del Codice degli appalti e la scelta della procedura d’acquisto, la costruzione del capitolato di gara, la scelta del criterio di aggiudicazione (offerta economicamente più vantaggiosa o prezzo più basso), la determinazione dei requisiti di qualità e la relativa parametrazione, la Commissione di gara, la gestione del contratto e la valutazione degli esiti della gara.
Al centro del sistema si pone il paziente, nel cui interesse devono muoversi gli altri attori, al fine di garantire l’appropriatezza prescrittiva verso il singolo paziente e la scelta del farmaco più appropriato per la patologia specifica, l’approvvigionamento tempestivo, la libertà prescrittiva del medico, la continuità terapeutica e l’accesso all’innovazione.
Sono inoltre fondamentali alcuni elementi legati al contesto specifico locale quali il coinvolgimento dei medici specialisti prescrittori per la condivisione dei provvedimenti regionali, anche tramite accordi su specifici indicatori di spesa e di appropriatezza e la partecipazione alla costruzione del capitolato di gara e dei lotti, nonché la presenza di sistemi informatici per il monitoraggio delle prescrizioni e di sistemi di informazione continua dei medici specialisti prescrittori sui prezzi di acquisto/costi terapia.
Il Codice degli appalti ha innescato una rimodulazione del processo degli acquisti
Infine, nelle diverse esperienze di aggiudicazioni delle varie centrali di committenza si stanno evidenziando alcune criticità che vanno tenute presenti, come ad esempio le differenti condizioni di aggiudicazione (durata di validità e riapertura del confronto ad ogni uscita di un nuovo biosimilare, ecc..), i diversi prezzi ottenuti sul territorio nazionale, la disponibilità di diverse tipologie di farmaci (un unico farmaco o più farmaci), l’aggiudicazione del prodotto soltanto per pazienti naïve o per tutti, il ricorso soltanto al primo in graduatoria di un accordo quadro.
Con l’introduzione del Codice degli appalti, il processo degli acquisti è stato al centro di una rimodulazione da parte di tutti gli operatori.
La Società Italiana di Farmacia Ospedaliera e dei Servizi Farmaceutici delle Aziende Sanitarie (SIFO) e la Federazione delle Associazioni Regionali Economi e Provveditori della Sanità (FARE) stanno sviluppando un progetto dal titolo “Acquisto dei farmaci e dei dispositivi medici alla luce del Nuovo Codice degli appalti” con l’obiettivo di pervenire a regole condivise sulla strutturazione dei contenuti sostanziali del ciclo dell’appalto, dalla definizione dei fabbisogni all’esecuzione dei contratti e alla verifica degli esiti delle gare (mediante un confronto tra le diverse esperienze).
In quest’ottica vorremmo qui presentare alcune riflessioni sulla costruzione del capitolato di gara, soffermandoci su alcuni elementi della normativa e, in particolare, sui criteri di aggiudicazione e sulla valorizzazione della qualità.
Il primo punto da affrontare rimane la fase di determinazione dei fabbisogni, che ha assunto un nuovo e diverso significato per una serie di motivi: infatti, la normativa impone il rispetto dell’importo messo a gara e associato al contratto e al CIG (Codice Identificativo Gara); inoltre, nella gestione di farmaci ad alto costo, con possibilità di una grande variabilità della spesa, è necessario poter disporre di una previsione precisa della spesa da sostenere per il bilancio aziendale; infine, definire con precisione un fabbisogno qualitativo e quantitativo consente di determinare i contratti per tutti i prodotti da utilizzare, garantendone una tempestiva messa a disposizione. La definizione dei fabbisogni “qualitativi” viene effettuata tramite la Commissione terapeutica, mentre la definizione dei fabbisogni “quantitativi” si poggia sull’analisi dello storico, su analisi previsionali e su modelli statistici. La normativa attuale assegna alla Commissione terapeutica un nuovo compito, cioè determinare le conseguenze correlate con l’inserimento di nuovi farmaci e/o dispositivi medici (DM) sia in termini economici sia in termini di utilizzo: quanti e quali farmaci e/o DM entreranno nel Prontuario, quanti e quali saranno sostituiti? Si impone quindi la necessità di integrare l’attività della Commissione del Prontuario Terapeutico Regionale con quella di chi è preposto all’elaborazione di un capitolato di gara e con quella svolta dalla Regione. In quest’ottica, risulterebbe opportuno da parte degli operatori avvalersi del contributo delle ditte produttrici che hanno a disposizione dati indispensabili per determinare le suddette valutazioni sui nuovi farmaci e DM ma che sono di difficile reperibilità, come dati epidemiologici e analisi di budget impact.
Un altro punto sul quale soffermarsi è l’equivalenza terapeutica: a questo proposito, il progetto SIFO-FARE suggerisce di stabilire un percorso univoco che, attraverso la corretta interpretazione della normativa e le sentenze di tribunali amministrativi e del Consiglio di Stato, arrivi ad elaborare un algoritmo per ogni gruppo di farmaci su come poter associare il più appropriato capitolato di gara, in un contesto costantemente aggiornato sulla base delle più recenti evidenze scientifiche.
L’art. 51 del Codice degli appalti definisce la suddivisione in lotti e ne affida il compito alle stazioni appaltanti. Sotto il profilo concorrenziale, nel formare i lotti vanno tenuti presenti i seguenti criteri di ordine generale (Antitrust – segnalazione 28/9/1999):
- individuare il giusto numero di lotti;
- individuare la giusta dimensione di lotti: non ricomprendere nell’oggetto della gara più attività che, prese singolarmente, esplicano una funzione economica o tecnica e che quindi potrebbero da sole costituire oggetto di appalto; non frazionare il progetto in singoli lotti al fine di eludere la disciplina comunitaria sugli appalti pubblici se ciò comporta che alcuni di essi siano poi sprovvisti di una propria funzione economica o tecnica;
- favorire la partecipazione di nuovi concorrenti: il relativo valore deve essere adeguato in modo da garantire l’effettiva possibilità di partecipazione da parte di microimprese, piccole e medie imprese;
- aggiudicare il lotto a due (o più) fornitori, che resteranno in competizione per l’intera durata contrattuale;
- aggregare la domanda tramite accorpamenti di fabbisogni;
- valutare attentamente la formazione di lotti composti (stesso principio attivo e più formulazioni/dosaggi);
- motivare obbligatoriamente la mancata suddivisione in lotti.
La determinazione del prezzo a base d’asta risulta essere un passaggio fondamentale perché, da un lato, deve garantire la partecipazione a più concorrenti possibile e, dall’altro, deve garantire di ottenere un prezzo di aggiudicazione più basso possibile. Pertanto, tale equilibrio non può essere lo stesso per tutti i tipi di prodotti e il prezzo a base d’asta va determinato di volta in volta a seconda della tipologia di farmaci da mettere in concorrenza. Occorre conoscere il mercato, il numero dei concorrenti, i risultati delle gare di altre stazioni appaltanti, la significatività dell’importo messo a gara rispetto a quello delle altre stazioni appaltanti e poi dedurre la soluzione più appropriata. La normativa ci dice che il prezzo base d’asta dovrà essere “il prezzo di mercato”, vale a dire, il prezzo di aggiudicazione delle diverse centrali di committenza, il più basso o il prezzo medio oppure, per le molecole per le quali esiste il biosimilare, il prezzo più basso di registrazione dei biosimilari.
Vale la pena riportare come esempio quello dei farmaci oncologici genericabili endovenosi, laddove si assiste a tutt’oggi a gare con un prezzo base d’asta sempre più basso, in una situazione in cui i prezzi di registrazione dei farmaci sono già molto bassi e i risultati delle gare sono lotti deserti o interruzione della fornitura.
Nel capitolato di gara può essere prevista la possibilità di accettare offerte che superino la base d’asta in maniera tale di garantirsi la possibilità di ricorrere ad alcune molecole per eventuali esigenze (continuità terapeutica e/o nel caso in cui non ci siano offerte al di sotto della base d’asta prevista).
Focalizzandoci sulla valorizzazione della qualità, il Codice degli appalti ha introdotto il criterio dell’offerta economicamente più vantaggiosa (OEPV) sulla base del miglior rapporto qualità/prezzo che consente:
- di assegnare un’importanza preminente al profilo tecnico-qualitativo rispetto a quello economico;
- di non aggiudicare l’appalto ad un’offerta che, ancorché conveniente sotto il profilo economico, non sia apprezzabile sotto il profilo tecnico;
- di fissare una soglia di sbarramento per l’aspetto tecnico- qualitativo al di sotto della quale le offerte non saranno valutate;
- di inserire la qualità dell’offerente tra i criteri di aggiudicazione.
Pertanto, diventa cruciale la definizione di che cosa valutare ed è necessario fissare un livello qualitativo minimo e un livello di qualità massima valorizzabile, considerando che bisogna evitare di pagare un prezzo alto per una qualità ridondante rispetto all’uso previsto: si deve valorizzare non la qualità assoluta, ma la qualità utile nel contesto dato.
Ai due estremi, rimane possibile l’aggiudicazione facendo prevalere il criterio del minor prezzo, o valorizzando solo parametri qualitativi.
Il criterio di miglior rapporto qualità/prezzo costituisce per le imprese, nel lungo-medio periodo, un’opportunità per far emergere le loro capacità, assicurando una maggiore concorrenza, ma nell’immediato richiede maggiori oneri per la formulazione delle offerte tecniche.
Redditività, costo di utilizzazione e costo dell’intero ciclo di vita del prodotto diventano parametri valutativi imprescindibili per la determinazione del costo totale di un prodotto. Si impone dunque di identificare un differenziale tra prodotti diversi che abbiano (o meno) principi attivi diversi e, se questo differenziale esiste, andrà correttamente identificato, valutato, qualificato, misurato, pesato e inserito in un sistema di ponderazione.
Il concetto di qualità viene a dir poco “esploso” e dovrà essere declinato nei suoi vari aspetti (Figura 1):
- qualità;
- organizzazione, qualifiche ed esperienza;
- servizi post-vendita e assistenza tecnica.
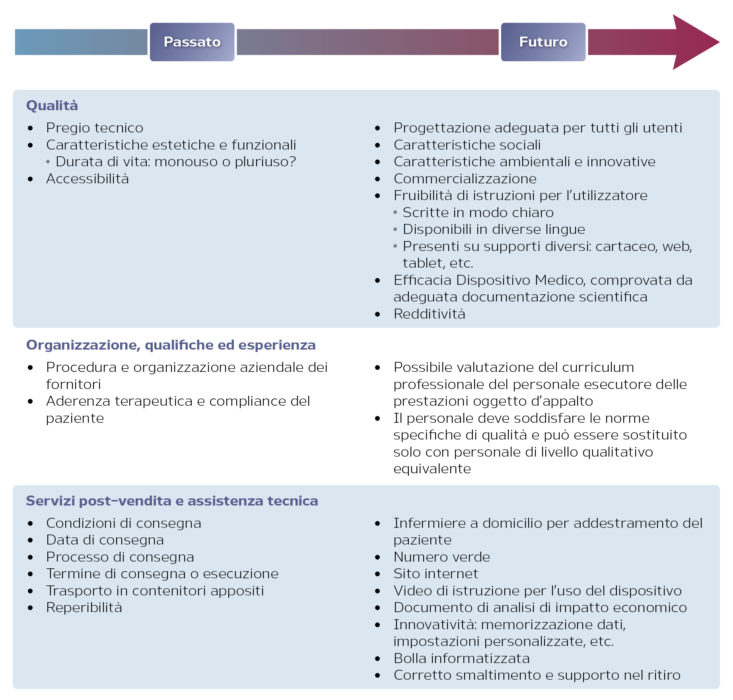
Figura 1. Possibile evoluzione del concetto di qualità con il Codice degli appalti
Nel contesto del Progetto SIFO-FARE, con il contributo dei membri del Board e del tavolo tecnico “Farmaci”, è stata elaborata una “Scheda di qualità” che riporta i parametri qualitativi relativi ai farmaci, alle apparecchiature e/o ai DM e ai servizi, individuando una serie di piani e competenze (Tabella I e Appendice) che hanno l’obiettivo di supportare gli operatori nella valorizzazione della qualità in fase di costruzione del capitolato.
Parametri qualitativi legati al farmaco |
| Commissione di gara |
| Commissione terapeutica | |
Parametri qualitativi legati ad apparecchiature e/o dispositivi medici |
| Commissione di gara |
Parametri qualitativi legati ai servizi correlati |
| Commissione di gara |
Tabella I. Struttura della Scheda qualità elaborata dal progetto SIFO-FARE
(La scheda di qualità per intero si riporta in Appendice)
Il cosiddetto Correttivo appalti, cioè il D.Lgs. 56/2017, ha introdotto un tetto massimo per il punteggio economico entro il 30%, con la conseguenza che il punteggio attribuito alla qualità e ai suoi requisiti risultava almeno pari al 70%.
Nell’ambito del progetto SIFO-FARE si è predisposto un documento a firma congiunta con Assobiomedica, Assogenerici, Cittadinanzattiva e Farmindustria, in cui sono state riportate alcune criticità sul Codice degli appalti con relative proposte correttive. In particolare, tra le altre proposte emendative, il documento conteneva una richiesta di modifica del comma 10 bis, art. 95 scaturita dalla considerazione che, a seguito del tetto massimo del 30% per il punteggio economico introdotto dal Correttivo appalti, nella pratica si è verificato un maggior utilizzo del criterio del minor prezzo a discapito della valorizzazione della qualità, con un effetto contrario all’obiettivo di promozione della qualità previsto dal legislatore.
Nel documento SIFO-FARE si auspicava dunque che il Codice fornisse indicazioni di utilizzo per macro tipologie di prodotti, in particolare nella fornitura di beni e servizi in ambito sanitario, con applicazione di rapporti prezzo/qualità diversificati, rimessi alla discrezionalità delle stazioni appaltanti. Tale documento è stato consegnato nei primi giorni di aprile al Capo di Gabinetto del Ministero della Salute.
L’obiettivo è valorizzare non la qualità assoluta ma la qualità utile nel contesto dato
Pochi giorni dopo si è avuta una prima modifica del Codice, con il Decreto Legge n. 32 del 18 aprile 2019, che ha previsto un cambio sostanziale di orientamento, accogliendo la modifica del tetto massimo del 30% per il punteggio economico e riconducendo la valutazione alle stazioni appaltanti. Inoltre il Decreto Legge n. 32 ha ripristinato il ricorso al prezzo più basso come prima opzione per il criterio di aggiudicazione, stabilendo che il ricorso all’offerta economicamente più vantaggiosa debba avvenire «previa motivazione»; nella precedente normativa, era il prezzo più basso a dover essere motivato dalla stazione appaltante che intendeva avvalersene. Per non andare contro la direttiva comunitaria ed evitare eventuali infrazioni, la modifica si applica solo agli appalti sotto soglia comunitaria.
Appendice: scheda qualità elaborata dal progetto SIFO-FARE con il contributo dei membri del Board e del tavolo tecnico “Farmaci”
Parametri qualitativi legati al farmaco | |
Piano farmaceutico * |
|
Piano farmacologico # |
|
Piano tossicologico # |
|
Piano regolatorio # |
|
Parametri qualitativi legati ad apparecchiature e/o dispositivi medici | |
Piano tecnologico * |
|
Parametri qualitativi legati ai servizi correlati | |
Piano logistico * |
|
Piano di assistenza post-vendita * |
|
* Competenza: commissione di gara; # Competenza: commissione terapeutica




