Procurement e innovazione rappresentano due temi chiave per il sistema sanitario italiano e in particolare nel settore dei dispositivi medici, in cui l’innovazione, quella vera, è spesso molto rapida e dirompente. È uno dei punti critici per il SSN: come può la pubblica amministrazione acquistare i device innovativi nei tempi e nei modi più adatti alla veloce evoluzione tecnologica?
L’obiettivo rimane, naturalmente, quello di mettere a disposizione di clinici e pazienti le tecnologie più innovative celermente, anche se le procedure, in genere, non brillano per sveltezza.
Da più parti si parla della necessità di un nuovo approccio alla sanità, basato sui risultati, che deve però essere supportato anche da soluzioni innovative correlate al valore per quanto riguarda le procedure di acquisto.
Come può la pubblica amministrazione acquistare i device innovativi nei tempi e nei modi più adatti alla veloce evoluzione tecnologica?
Il value based procurement rappresenta un approccio promettente, ma la sua applicazione pratica genera ancora forti resistenze, a diversi livelli, sia per la pubblica amministrazione sia per gli operatori economici. Serve un cambio di paradigma per tradurre il concetto di “qualità” in “valore”, da declinare in criteri di gara.
La qualità di cui tenere conto non dovrebbe essere più (o non soltanto) quella intrinseca (ovvero basata sulle caratteristiche tecniche/funzionali del dispositivo), ma quella basata sull’outcome clinico. Ne consegue la necessità di spostare il focus sulle attività che generano risultati attraverso la misurazione del rapporto fra l’organizzazione di un certo percorso di cura, i costi sostenuti e gli esiti.
Per i dispositivi medici ad alta tecnologia, il problema è ancora più sentito: non è semplice, infatti, per la pubblica amministrazione, percepire la reale innovatività dei prodotti, stabilirne il valore in sede di gara e monitorare gli esiti nella fase di esecuzione del contratto.
Per fare chiarezza, ne abbiamo parlato nel corso di una Live che ha visto come ospiti l’ingegner Gian Luca Viganò, direttore dell’unità operativa complessa di Ingegneria Clinica degli Spedali Civili di Brescia e vice presidente dell’Associazione Lombarda Provveditori, e l’avvocato Roberto Bonatti, esperto in contratti pubblici e diritto della concorrenza, dello studio legale Russo Valentini di Bologna.
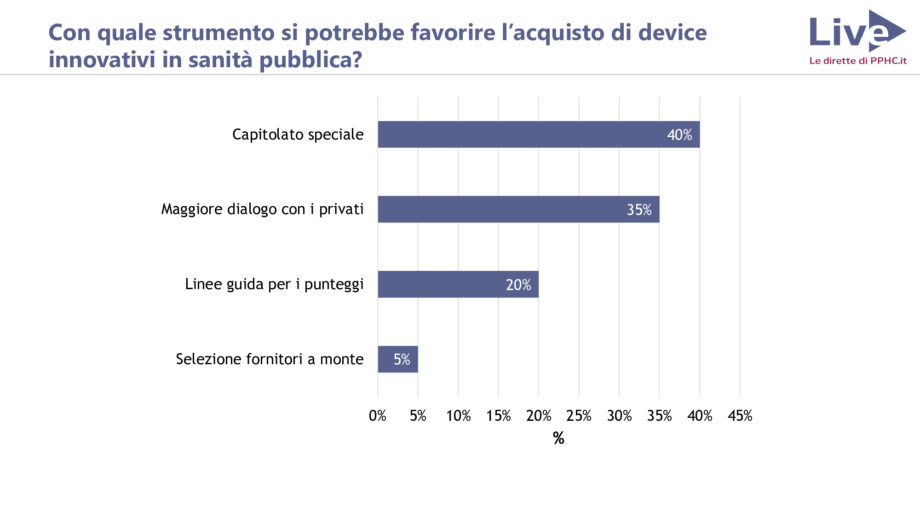
Capitolato speciale per l’innovazione o maggiore dialogo con i privati?
Con quale strumento si potrebbe favorire l’acquisto di device innovativi nella sanità pubblica? Secondo gli utenti di PPHC.it, interpellati tramite i nostri canali social, la soluzione potrebbe essere il ricorso a un capitolato speciale dedicato all’innovazione, insieme a un maggiore dialogo con il privato.
“Il capitolato speciale per l’innovazione rappresenta una soluzione adatta soprattutto per chi imputa al capitolato la parte essenziale di una gara – afferma Viganò – A mio parere, è invece un più stretto dialogo con i privati che può favorire l’acquisto di device innovativi, perché è fondamentale, soprattutto nel campo dell’innovazione tecnologica, capire quello che il mercato ci offre. Altrimenti si rischia di concentrarsi di più solo sugli aspetti tecnici”.
Un parere condiviso anche da Bonatti: “Il dialogo con i privati serve all’amministrazione per leggere il mercato e capire come strutturare il capitolato in chiave di innovazione. C’è un rapporto di strumentalità fra i due elementi: se manca il dialogo con il privato, la PA difficilmente riesce ad “inventarsi” un capitolato innovativo. Il punto da chiarire è come e con quali procedure condurre questo dialogo”.
La resistenza al cambiamento rappresenta l’ostacolo maggiore
I risultati del secondo sondaggio hanno invece messo in evidenza le forti resistenze a livello culturale ancora presenti nel sistema: il 42% dei partecipanti ha infatti individuato nella resistenza al cambiamento il maggiore ostacolo alla valorizzazione dell’innovazione in sanità da parte della PA, seguita dalla questione relativa all’eccessiva lunghezza dei tempi correlati alle procedure.
Elementi confermati anche dall’esperienza dell’ingegner Viganò: “La necessità di progresso culturale, soprattutto per quanto riguarda i dispositivi medici dove bisogna seguire velocemente il cambiamento e quanto propone il mercato, è difficile da conciliare con i ritmi e le regole della PA. Di conseguenza, è necessario trovare una modalità smart, semplificata ma che rispetti le regole, per poter abbreviare i tempi affinché siano consoni con l’aggiornamento tecnologico del settore”.
Anche dal punto di vista normativo si riscontra la tendenza a servirsi sempre delle stesse procedure, a volte troppo standardizzate. “Nel momento storico in cui viviamo è necessario recuperare la qualità – ricorda Bonatti – Negli ultimi anni l’esigenza è stata quella di risparmiare a tutti i costi e troppo spesso nelle gare per i DM si è sacrificata la parte della valutazione della qualità nelle offerte a fronte delle sole esigenze di risparmio. Troppo spesso la struttura del capitolato o anche soltanto la formula matematica per l’attribuzione del testo alla fine vanificavano gli sforzi di innovazione che la parte tecnica del capitolato magari poteva consentire”.

Che cosa si intende per innovazione?
Nell’ambito della tecnologia, non solo per i dispositivi ma anche per le apparecchiature, dare una definizione di innovazione non è semplice. Spesso chi affronta il tema, anche dal lato procurement, si trova davanti a un bivio: quando possiamo davvero parlare di innovazione e quando invece si tratta di aggiornamento tecnologico?
 “L’innovazione è un percorso a tutto tondo – così la pensa l’ingegner Viganò – e va valutata partendo dai fabbisogni e arrivando alla definizione puntuale dell’obiettivo che si vuole ottenere rispetto ai parametri di riferimento”.
“L’innovazione è un percorso a tutto tondo – così la pensa l’ingegner Viganò – e va valutata partendo dai fabbisogni e arrivando alla definizione puntuale dell’obiettivo che si vuole ottenere rispetto ai parametri di riferimento”.
Viganò sottolinea anche la sfida rappresentata dalla corretta identificazione del fabbisogno. Come affrontarla con successo? “Il modo migliore è realizzare un tavolo multidisciplinare, che coinvolga tutte le figure che hanno una necessità da inserire nel fabbisogno (ad esempio, il clinico, il farmacista, il provveditore) – riprende l’ingegnere – Successivamente si definiscono gli strumenti che consentano di esplicitare l’obiettivo che si vuole raggiungere in modo che il mercato lo capisca.
Quando possiamo davvero parlare di innovazione e quando invece si tratta di aggiornamento tecnologico?
Per questa ragione il confronto con il privato è fondamentale. Molto spesso l’obiettivo è espresso in termini di capitolato e specifiche tecniche ma talvolta, e con l’acquisto di innovazione dovrebbe diventare più frequente, è espresso come outcome clinici. In questo secondo caso cambia il punto di vista: si mette al centro il paziente e non tanto l’obiettivo della procedura di gara”.
Il rapporto con l’originalità è un elemento chiave di valutazione dell’innovazione: “Non necessariamente devo capire subito che è innovativo quello che mi stanno proponendo, ma devo capire subito che è innovativo rispetto al mio fabbisogno. L’originalità è la premessa per l’innovazione”, sottolinea Viganò.
Strumenti di procurement per l’innovazione oggi disponibili e modalità di utilizzo
La richiesta di procedure ad hoc per l’innovazione è molto presente, così come la necessità di vincere le resistenze al cambiamento che non sono solo della PA ma spesso anche degli operatori economici. Per superare questa situazione, alcuni strumenti normativi sono già presenti ma risultano spesso poco usati.
 “Partiamo da una premessa – riprende l’avvocato Bonatti. Prima di scegliere il modo con cui acquistare innovazione, la PA deve innanzitutto chiedersi che cosa desidera comprare: un dispositivo medico (una fornitura tout court), un service (una fornitura inserita all’interno di un appalto più complesso in cui il DM occupa un ruolo specifico insieme ad altri servizi o prodotti) oppure un risultato. Comprare un risultato significa prescindere dal prodotto o dai prodotti che compongono il sistema che si intende acquistare, per passare a una visione finalistica orientata all’obiettivo: l’amministrazione desidera raggiungere un certo risultato e valuta le diverse soluzioni possibili per arrivarci”.
“Partiamo da una premessa – riprende l’avvocato Bonatti. Prima di scegliere il modo con cui acquistare innovazione, la PA deve innanzitutto chiedersi che cosa desidera comprare: un dispositivo medico (una fornitura tout court), un service (una fornitura inserita all’interno di un appalto più complesso in cui il DM occupa un ruolo specifico insieme ad altri servizi o prodotti) oppure un risultato. Comprare un risultato significa prescindere dal prodotto o dai prodotti che compongono il sistema che si intende acquistare, per passare a una visione finalistica orientata all’obiettivo: l’amministrazione desidera raggiungere un certo risultato e valuta le diverse soluzioni possibili per arrivarci”.
In concreto, diverse sono le procedure a disposizione, a partire dalla cosiddetta gara tradizionale, all’interno della quale è possibile però già inserire un livello “minimo” di innovazione prevedendo una adeguata e approfondita istruttoria pre-gara. Specifica Bonatti: “Nel momento in cui l’amministrazione conosce bene lo stato del mercato e le caratteristiche tecniche dei prodotti già presenti sul mercato è in grado di strutturare una gara e indicare le sue esigenze in modo preciso e puntuale”.
La richiesta di procedure ad hoc per l’innovazione è molto presente, così come la necessità di vincere le resistenze al cambiamento
Un passo ulteriore può essere fatto con il dialogo competitivo, con o senza negoziazione. Questa forma, che ha sostituito l’appalto concorso, ha la finalità di sollecitare le imprese presenti sul mercato a proporre soluzioni originali, che non significa necessariamente innovative, ma l’originalità è una delle premesse per l’innovazione. “La procedura del dialogo competitivo potrebbe trovare maggiore spazio nell’acquisto di DM – ricorda Bonatti – se si vuole incentivare l’innovazione”.
A livelli più alti e più spinti di innovazione si riferiscono il partenariato pubblico-privato, il partenariato per l’innovazione e, con terminologia in parte simile, gli appalti per l’innovazione. “Dal punto di vista giuridico però queste procedure possono essere utilizzate solo se il prodotto o il servizio non è presente sul mercato, e quindi questo può rappresentare un limite”, specifica Bonatti.
Tra i vari strumenti di procurement a disposizione, oltre a quelli già menzionati, l’ingegner Viganò ricorda anche la prova visione e la consultazione di mercato, che possono essere utilmente utilizzate sempre nell’ottica di mettere alla prova la tecnologia e ricavarne delle evidenze e per avere piena contezza dello stato dell’arte delle tecnologie in grado di soddisfare i fabbisogni della PA.
Il ruolo dell’HTA
Il nodo della oggettivazione delle caratteristiche della tecnologia è fondamentale e forse, in questo senso, sarebbe auspicabile un maggior legame tra HTA (Health Technology Assessment) e procurement.
Come ha ricordato l’ingegner Viganò, la valutazione dell’innovazione si esplica nelle diverse fasi del processo di acquisto. Nella fase del pre-gara, che comprende anche la definizione del fabbisogno, è fondamentale individuare gli strumenti che consentano all’amministrazione di raggiungere gli obiettivi che si è posta. In questa fase, come anche nella fase di gara vera e propria, è importante poter contare su strumenti il più possibile oggettivi, che forniscano delle chiavi di lettura adeguate per poter tradurre in termini proponibili per il mercato le esigenze di fabbisogni, risultati e ciclo di vita.
Il tema della oggettivazione delle caratteristiche della tecnologia è fondamentale e pertanto sarebbe auspicabile un maggior legame tra HTA e procurement
Nella fase di esecuzione del contratto, cruciale è invece il monitoraggio degli obiettivi prefissati nel bando di gara e che devono essere garantiti da vincitori e aggiudicatari. Ribadisce Viganò: “Tutti gli strumenti a supporto del direttore dell’esecuzione del contratto, che vadano a monitorare le attività e il ciclo di vita, gli outcome, i KPI (Key Performance Indicator) che abbiamo definito, sono fondamentali per verificare se sono stati raggiunti gli obiettivi di innovazione auspicati”.
È qui che l’HTA può far valere tutta la sua utilità poiché consente di definire di che cosa l’amministrazione ha bisogno. Riassume Viganò: “L’HTA è uno strumento per sua natura multidimensionale e multidisciplinare. Multidisciplinare perché mette insieme tutti gli specialisti che devono affrontare il tema specifico, cioè l’oggetto della gara, che deve essere tradotto in obiettivi e specifiche. Multidimensionale perché affronta in modo oggettivo tutti i parametri che interessano il fabbisogno di tecnologia, e quindi tutte le implicazioni medico-cliniche, sociali, economiche”.
Nuove soluzioni per valorizzare l’innovazione
Valorizzare la qualità e l’innovazione già in sede di gara significa incentivare in maniera più significativa l’innovazione perché si subordina a questo parametro l’individuazione del fornitore stesso, stimolando così le imprese sul mercato a proporre fin da subito soluzioni innovative.
“Gli strumenti per tenere in considerazione l’innovazione durante la gara sono tanti – prosegue Bonatti – . A mio parere, il primo essenziale strumento è la formulazione dei criteri di valutazione qualitativa sotto forma di requisito funzionale. Cioè senza descrivere le caratteristiche tecniche del prodotto ma descrivendo l’obiettivo, il risultato finale in termini di funzione che l’amministrazione si attende dall’uso di quel prodotto. Si tratta di un vero cambio di approccio nella scrittura dei capitolati. È chiaro che ognuno ha in mente i prodotti presenti sul mercato e le loro caratteristiche oggettive sono note a tutti i concorrenti e a tutte le amministrazioni. Però un conto è descrivere le caratteristiche fisiche di un prodotto ai fini dell’attribuzione del punteggio, un altro conto è immaginarsi quale possa essere la funzione di questa caratteristica e richiedere tale funzione. Questo è essenziale perché consente di sviluppare soluzioni di cui magari l’amministrazione non si era resa conto in sede di istruttoria di gara ma che il concorrente riesce a sviluppare sulla base dell’art. 68 e sul principio di equivalenza”.
Valorizzare la qualità e l’innovazione già in sede di gara significa incentivare in maniera più significativa l’innovazione
Un altro strumento per apprezzare l’innovazione di un prodotto è rappresentato dalla valutazione in termini di punteggio di alcuni parametri di outcome riportati nell’ambito di studi, nazionali o internazionali, a discrezione dell’amministrazione e in base al tipo di categoria merceologica. Il ricorso alla letteratura scientifica da un lato consente alla PA di fare riferimento a dati ottenuti dalla ricerca ad alti livelli, ma presenta alcune criticità legate alla verifica dell’attendibilità (gli studi devono essere condotti secondo rigorosi criteri scientifici) e alla questione linguistica, che potrebbero far allungare i tempi di gara. Inoltre, nel caso di prodotti non solo innovativi ma anche di recente immissione sul mercato, la letteratura scientifica a supporto potrebbe essere numericamente minore, pertanto si pone la questione di come sperimentare un modo diverso di valutare l’innovazione per non penalizzare questo tipo di prodotti.
Valutare il cosiddetto “ciclo di vita” non solo del dispositivo ma di tutto il percorso diagnostico terapeutico all’interno del quale viene prescritto il singolo dispositivo costituisce un ulteriore passo verso il cambio di mentalità che da più parti si auspica. In questo senso, l’utilizzo di un device piuttosto che di un altro, anche a fronte di maggiori costi di acquisto, potrebbe generare risparmi in termini di procedure o di rischio clinico sugli operatori, e di conseguenza potrebbe rappresentare un’opzione maggiormente sostenibile per il sistema in chiave di complessiva economicità.
Non esiste quindi una sola ricetta per valorizzare l’innovazione negli acquisti della PA, ma tante, da scegliere di volta in volta in base al tipo di prodotto che l’amministrazione vuole acquistare e alle finalità che si prefigge.




