L’innovazione, spesso supportata dalle tecnologie digitali, sta trasformando profondamente, anche nel nostro Paese, il settore Life Science. Le nuove tecnologie offrono la possibilità ai diversi attori del settore di sviluppare nuovi prodotti e servizi, come farmaci e terapie innovative e sensori, e di innovare gli stessi processi di ricerca, dai Decentralized Clinical Trial all’uso di Real World Data, permettendo di ottenere benefici importanti per l’intero ecosistema e, soprattutto, per il paziente.
Alcune innovazioni sono già entrate nelle strategie delle aziende del settore: il 25% delle aziende Pharma che operano in Italia afferma di aver già incluso nella propria offerta Terapie Avanzate, mentre il 46% di aver sviluppato altri farmaci innovativi. Alcune innovazioni si devono ancora affermare nel nostro Paese, come le Terapie Digitali, dispositivi medici basati su App e/o videogiochi prescritte dal medico in combinazione a un farmaco o standalone, che nel contesto italiano sono ancora in attesa di rimborsabilità e maggiore chiarezza sul percorso di validazione clinica necessario. Il 36% delle aziende del settore, le considera però tra le priorità per il futuro. L’innovazione riguarda anche le modalità con cui sono condotte le sperimentazioni cliniche. L’emergenza sanitaria ha costretto molti centri di ricerca a svolgere alcune fasi da remoto, andando nella direzione dei Decentralized Clinical Trial. Come emerso dalla rilevazione svolta in collaborazione con Ame, Amco, Fadoi, Pke e Simfer, il 25% dei medici specialisti ha già partecipato a sperimentazioni cliniche con almeno una fase decentralizzata e il 50% di chi non l’ha ancora fatto sarebbe interessato a farlo in futuro.
Tuttavia, il grande impatto potenziale è sui pazienti. Tra i pazienti cronici o con problematiche gravi – coinvolti nella ricerca in collaborazione con Aisc, Alleanza Malattie Rare, Apmarr, Fand, FederAsma, Onconauti e Ropi – emerge che sei pazienti su dieci sono propensi a utilizzare terapie avanzate, se consigliate dal proprio medico. Tre su quattro, invece, sarebbero interessati a prendere parte a una sperimentazione clinica che coinvolga l’utilizzo di tecnologie digitali come i dispositivi indossabili e la tele-visita.
Sorprende l’accettazione verso sensori impiantabili o ingeribili: un cittadino italiano su due è propenso a utilizzare un sensore di questo tipo per raccogliere dati su parametri clinici per monitorare una patologia
Sorprende l’accettazione verso sensori impiantabili o ingeribili: un cittadino italiano su due è propenso a utilizzare un sensore di questo tipo per raccogliere dati su parametri clinici per monitorare una patologia, se consigliato dal medico curante, mentre per i pazienti coinvolti nella ricerca la propensione è ancora più elevata e arriva al 62% per i sensori ingeribili.
Sono alcuni dei risultati della ricerca dell’Osservatorio Life Science Innovation della School of Management del Politecnico di Milano, presentata durante il convegno “Life Science: cavalcare l’onda dell’innovazione”.

Il settore Life Science, strategico e in evoluzione, è formato da oltre 500 aziende e conta circa 190 mila dipendenti; ha un valore di produzione di oltre 55 miliardi.
 “L’ecosistema Life Science è oggi colpito da più onde di innovazione tecnologica sia radicale che incrementale che stanno disegnando nuovi scenari di cura del paziente e dischiudendo nuove opportunità – commenta Emanuele Lettieri, responsabile scientifico dell’Osservatorio Life Science Innovation -. Tutti i player di questo ecosistema sono chiamati a comprendere come cavalcarla, per non rimanerne travolti. Per riuscirci, bisogna accelerare la trasformazione culturale di questo ecosistema, creando maggiore consapevolezza e nuove competenze, sviluppare normative e regolamenti sia a livello europeo sia nazionale e favorire la condivisione di conoscenze, strumenti e best practice su scala almeno europea”.
“L’ecosistema Life Science è oggi colpito da più onde di innovazione tecnologica sia radicale che incrementale che stanno disegnando nuovi scenari di cura del paziente e dischiudendo nuove opportunità – commenta Emanuele Lettieri, responsabile scientifico dell’Osservatorio Life Science Innovation -. Tutti i player di questo ecosistema sono chiamati a comprendere come cavalcarla, per non rimanerne travolti. Per riuscirci, bisogna accelerare la trasformazione culturale di questo ecosistema, creando maggiore consapevolezza e nuove competenze, sviluppare normative e regolamenti sia a livello europeo sia nazionale e favorire la condivisione di conoscenze, strumenti e best practice su scala almeno europea”.
Decentralized Clinical Trial: ha già partecipato il 25% degli specialisti italiani
L’innovazione digitale consente di ottimizzare alcune fasi del processo di ricerca e di sviluppo di un farmaco o di un dispositivo medico, ma può migliorare anche l’organizzazione dei trial clinici. L’emergenza sanitaria ha costretto molti centri di ricerca a svolgere alcune fasi delle sperimentazioni cliniche da remoto. Dalla ricerca svolta emerge grande interesse per i Decentralized Clinical Trial, cui hanno già partecipato già il 25% dei medici specialisti italiani. I potenziali benefici sono rilevanti: per i medici, l’opportunità di raccogliere un maggior numero di dati durante la sperimentazione (evidenziato dal 61% degli specialisti) e l’opportunità di differenziare maggiormente la tipologia di pazienti coinvolti (56%). Gli stessi benefici sono riconosciuti anche dai Data Manager (rispettivamente 75% e 54%) coinvolti nella ricerca, svolta in collaborazione con il Gruppo Italiano Data Manager (Gidm).
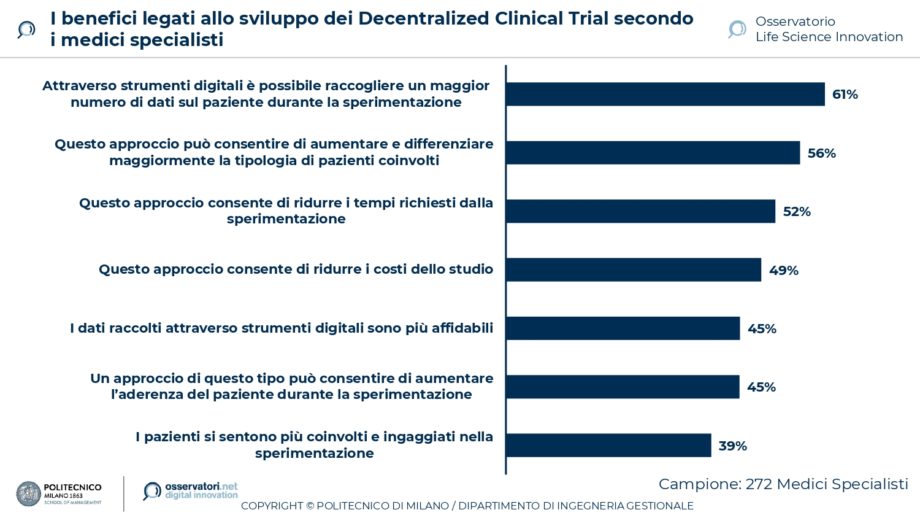
Le soluzioni digitali ad oggi più utilizzate nelle sperimentazioni cliniche sono quelle per digitalizzare e gestire i dati relativi ai pazienti che partecipano alla sperimentazione, come l’electronic Case Report Form (utilizzate dal 58% dei medici specialisti) e per raccogliere dati sui pazienti anche da remoto, come i dispositivi wearable (utilizzate dal 44%). Tra le soluzioni meno diffuse, ma di maggiore interesse per i medici, emergono quelle per fornire un supporto al paziente durante il trattamento.
 “In Italia, nonostante i numerosi benefici che i Decentralized Clinical Trial potrebbero apportare alla ricerca clinica, diverse barriere ne limitano ancora l’adozione – dichiara Chiara Sgarbossa, direttrice dell’Osservatorio Life Science Innovation -. Le più rilevanti riguardano la cultura e le competenze digitali degli attori coinvolti, dai professionisti agli stessi pazienti, l’incertezza legata al quadro normativo e alcune complessità legate alla gestione della privacy e sicurezza dei dati del paziente. È quindi prioritario sviluppare un contesto culturale, organizzativo e normativo che consenta di abbattere queste barriere”.
“In Italia, nonostante i numerosi benefici che i Decentralized Clinical Trial potrebbero apportare alla ricerca clinica, diverse barriere ne limitano ancora l’adozione – dichiara Chiara Sgarbossa, direttrice dell’Osservatorio Life Science Innovation -. Le più rilevanti riguardano la cultura e le competenze digitali degli attori coinvolti, dai professionisti agli stessi pazienti, l’incertezza legata al quadro normativo e alcune complessità legate alla gestione della privacy e sicurezza dei dati del paziente. È quindi prioritario sviluppare un contesto culturale, organizzativo e normativo che consenta di abbattere queste barriere”.
 Il tema dei Decentralized Clinical Trial è stato approfondito da Deborah De Cesare, ricercatrice senior dell’Osservatorio Life Science Innovation, a partire dalla definizione della Food And Drug Administration del 2021, secondo cui un Decentralized Clinical Trial è “una sperimentazione clinica nella quale alcune o tutte le attività legate alla sperimentazione avvengono in una sede diversa da quella dello sperimentatore”.
Il tema dei Decentralized Clinical Trial è stato approfondito da Deborah De Cesare, ricercatrice senior dell’Osservatorio Life Science Innovation, a partire dalla definizione della Food And Drug Administration del 2021, secondo cui un Decentralized Clinical Trial è “una sperimentazione clinica nella quale alcune o tutte le attività legate alla sperimentazione avvengono in una sede diversa da quella dello sperimentatore”.
Alla luce di questa definizione si comprende come la grande maggioranza degli studi del genere in corso non sia pertanto completamente decentralizzata, con tutte le attività e le visite previste da remoto, ma si tratti di studi ibridi, in cui avvengono in parte nel centro e in parte da remoto.
I pro: è possibile raccogliere un maggior numero di dati sul paziente (ad esempio Real World Data) durante la sperimentazione e si può aumentare e differenziare maggiormente la tipologia di pazienti coinvolti.
Tra le barriere ancora da superare, il grande nodo della privacy e della protezione dati e il fatto che i Digitalized Clinical Trial richiedono competenze digitali specifiche.
Da queste premesse ha preso il via la prima tavola rotonda.
II digitale può supportare e velocizzare alcune fasi del processo di #ricercaclinica. Andrea Beccari spiega quali sono le opportunità che mette a disposizione la piattaforma Exscalate e come funziona e quali ulteriori sviluppi potrà avere in futuro #OLS22 pic.twitter.com/wJFdCRg30P
— Osservatori Digital (@Osserv_Digital) July 12, 2022
Carlo Malgieri spiega quali sono le applicazioni che stanno sviluppando in @LaifeReply per il miglioramento dei processi di #ricercaclinica #OLS22 #lifescience pic.twitter.com/KbqnshHh02
— Osservatori Digital (@Osserv_Digital) July 12, 2022
Chiara Di Somma, funzionaria del Dipartimento Sanità e Ricerca dell’Autorità Garante per la Protezione dei Dati Personali, ha sottolineato come negli ulti anni l’attività del legislatore comunitario su questioni di ricerca scientifica sia al centro di un acceso dibattito, passando a distinguere tra elementi normativi già disponibili e altri de iure condendo.
“Studiando i documenti su Decentralized Clinical Trial, Intelligenza Artificiale e Real World Data, si riconosce l’ambizione di sfruttare le nuove tecnologie per porre il paziente al centro e in questa direzione serve ragionare su soggetto non solo come paziente ma anche come interessato, in termini di privacy: la sfida è trovare una sintesi”, ha commentato.
La raccolta di dati attraverso strumenti digitali può giocare un ruolo fondamentale nel miglioramento della ricerca clinica. Chiara Di Somma spiega qual è il contesto normativo di riferimento per l’utilizzo e la valorizzazione di questi dati e quali sono le novità #OLS22 pic.twitter.com/MzZyYHIXhU
— Osservatori Digital (@Osserv_Digital) July 12, 2022
“Il Gdpr offre strumenti per questo equo bilanciamento, ma è una questione che gli scienziati non possono affrontare da soli: si tratta di una normativa complessa, che a questo scopo introduce la figura del Data protection officer (Dpo) e precisa che è necessario si doti di una struttura per integrare competenze differenti – ha affermato -. Bisogna poi ricordare che la privacy ha un costo, che può essere considerato un’economia di scala, e che non tutto ciò che è possibile a livello tecnologico lo è anche su quello giuridico”.
Il trial decentralizzato impone una svolta in questo senso: serve una valutazione di impatto che chiamerà il titolare del trattamento a chiarire rischi e misure implementate per ridurre i rischi e garantire la sicurezza e verifiche costanti sull’adeguatezza delle misure. “Inoltre sarà necessario porre un occhio alla qualità dei fornitori che coinvolgiamo, assicurandosi che siano specchiati nell’applicazione della disciplina sulla privacy, per esempio aderendo a codici di condotta – ha detto Di Somma -. Attenzione anche ai possibili trasferimenti di dati verso Paesi terzi”.
I Real World Data, ha segnalato l’esperta, portano con sé anche altre problematiche, connesse all’esattezza del dato, soprattutto nel caso di pazienti non avvezzi alle tecnologie, o in tema di minimizzazione laddove le informazioni potrebbero risultare ridondanti rispetto alla finalità della ricerca. Insieme al Gdpr in questo senso sarà rilevante l’evoluzione dello Spazio europeo dati sanitari, che nasce con l’obiettivo di consentire la raccolta di dati sanitari non solo per fini di cura ma anche secondari, tra cui in particolare quello della ricerca.
 Nel dibattito è quindi intervenuta Sandra Petraglia, dirigente Ufficio Ricerca e Sperimentazione Clinica e Coordinatore dell’Area Pre-autorizzazione dell’Aifa. “Le riflessioni sul tema dei trial clinici decentralizzati risalgono a molti anni prima della pandemia, che possiamo però considerare uno spartiacque che ha portato a un profondo mutamento di scenario e sdoganato questo tipo di studi con una rapidità che non avremmo avuto solo sulla scia del processo tecnologico e digitale – ha spiegato -. Abbiamo notato come il 25-50% delle sperimentazioni presentate abbia adesso almeno un elemento decentrato e siamo state una delle prime agenzie nazionali a produrre una Guida alla presentazione della domanda di autorizzazione alla Sperimentazione Clinica che preveda l’utilizzo di sistemi di Intelligenza Artificiale (AI) o di Machine Learning (ML)”.
Nel dibattito è quindi intervenuta Sandra Petraglia, dirigente Ufficio Ricerca e Sperimentazione Clinica e Coordinatore dell’Area Pre-autorizzazione dell’Aifa. “Le riflessioni sul tema dei trial clinici decentralizzati risalgono a molti anni prima della pandemia, che possiamo però considerare uno spartiacque che ha portato a un profondo mutamento di scenario e sdoganato questo tipo di studi con una rapidità che non avremmo avuto solo sulla scia del processo tecnologico e digitale – ha spiegato -. Abbiamo notato come il 25-50% delle sperimentazioni presentate abbia adesso almeno un elemento decentrato e siamo state una delle prime agenzie nazionali a produrre una Guida alla presentazione della domanda di autorizzazione alla Sperimentazione Clinica che preveda l’utilizzo di sistemi di Intelligenza Artificiale (AI) o di Machine Learning (ML)”.
Uno degli aspetti su cui verte il dibattito a livello europeo, ha sottolineato, è l’integrazione della normativa del mondo del farmaco e del dispositivo medico: sarà predisposta una guidance unica, auspicata entro la fine dell’anno almeno per una presentazione al confronto pubblico.
Il punto di vista dell’industria è arrivato con Marco Zibellini, direttore della Direzione Tecnico Scientifica di Farmindustria.
Marco Zibellini @FarmindustriaTW spiega quali sono le opportunità e le sfide per le aziende Pharma in Italia nell’utilizzo di approcci di #DecentralizedClinicalTrial e nella raccolta di Real World Data: focus su privacy, adeguamento digitale dei centri, formazione #OLS22 pic.twitter.com/6ybaqcKdwQ
— Osservatori Digital (@Osserv_Digital) July 12, 2022
L’apertura dei pazienti verso le Terapie Avanzate e i sensori
Le aziende dell’ecosistema Life Science stanno cercando di trovare risposte a problemi e bisogni di cura finora irrisolti tramite il ripensamento delle terapie tradizionali. Per trattare patologie che non hanno ancora cure disponibili o per rispondere in maniera più efficace a specifici bisogni, emergono terapie innovative, come le Terapie Avanzate.
“Sono medicinali  biologici classificati in quattro categorie – spiega Gabriele Dubini, responsabile scientifico dell’Osservatorio Life Science Innovation – : medicinali di terapia genica (ad esempio le CAR-T), medicinali di terapia cellulare somatica, medicinali di ingegneria tissutale, anche ormai ottenibili mediante biostampa 3D di tessuti, e infine medicinali per terapie avanzate combinate, che contengono uno o più dispositivi medici come parte integrante del medicinale a base di cellule o tessuti. Le opportunità offerte sono però ancora poco conosciute alla maggior parte dei professionisti sanitari, che non hanno ancora maturato un giudizio su quanto possano essere promettenti per il futuro”.
biologici classificati in quattro categorie – spiega Gabriele Dubini, responsabile scientifico dell’Osservatorio Life Science Innovation – : medicinali di terapia genica (ad esempio le CAR-T), medicinali di terapia cellulare somatica, medicinali di ingegneria tissutale, anche ormai ottenibili mediante biostampa 3D di tessuti, e infine medicinali per terapie avanzate combinate, che contengono uno o più dispositivi medici come parte integrante del medicinale a base di cellule o tessuti. Le opportunità offerte sono però ancora poco conosciute alla maggior parte dei professionisti sanitari, che non hanno ancora maturato un giudizio su quanto possano essere promettenti per il futuro”.
Il 59% dei pazienti coinvolti nella ricerca è propenso a utilizzare questa tipologia di terapie se consigliate dal proprio medico
Interessante osservare che il 59% dei pazienti coinvolti nella ricerca è propenso a utilizzare questa tipologia di terapie se consigliate dal proprio medico.
Andrea Aliverti apre la seconda parte di presentazione dei risultati della ricerca: Classificazione sensori, Condivisione dei dati, Terapie Digitali i 3 temi su cui si concentra #OLS22 pic.twitter.com/Gkbo4WcJPl
— Osservatori Digital (@Osserv_Digital) July 12, 2022
Un altro ambito di innovazione di prodotto nel Life Science è quello dei sensori, indossabili, ingeribili e impiantabili. “Queste innovazioni possono abilitare la raccolta di  ingenti volumi di dati sul paziente, anche di Real World – commenta Alberto Redaelli, Responsabile Scientifico dell’Osservatorio Life Science Innovation -. Dalla ricerca svolta in collaborazione con Doxapharma su un campione rappresentativo della popolazione italiana, emerge che gli italiani ne riconoscono le potenzialità, tanto che uno su due sarebbe disponibile ad utilizzarne uno di tipo impiantabile o ingeribile, se fosse consigliato dal proprio medico”.
ingenti volumi di dati sul paziente, anche di Real World – commenta Alberto Redaelli, Responsabile Scientifico dell’Osservatorio Life Science Innovation -. Dalla ricerca svolta in collaborazione con Doxapharma su un campione rappresentativo della popolazione italiana, emerge che gli italiani ne riconoscono le potenzialità, tanto che uno su due sarebbe disponibile ad utilizzarne uno di tipo impiantabile o ingeribile, se fosse consigliato dal proprio medico”.
Inoltre, i pazienti sono aperti alla possibilità di condividere i dati raccolti dai sensori, e da altri strumenti digitali, per scopi come la diagnostica, la ricerca clinica, la medicina personalizzata. Circa un paziente su quattro si dice pronto a condividere i propri dati, non solo con le strutture che li hanno in cura, ma anche con altri attori, come le aziende che producono farmaci o dispositivi medici.
Terapie Digitali: superare l’incertezza in tema regolatorio
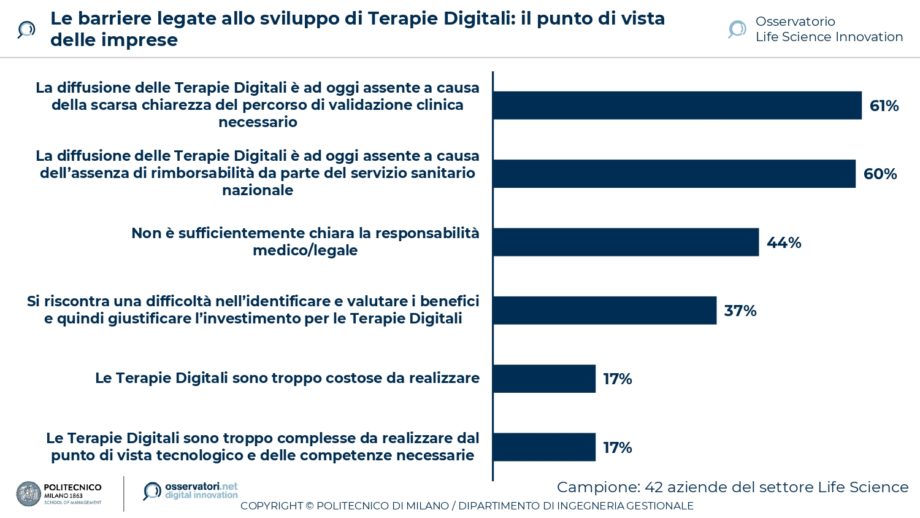
Le Terapie Digitali sono una delle più recenti e più promettenti tendenze di innovazione digitale nel Life Science. Si stanno ormai affermando a livello internazionale, in particolare negli USA e in Germania, mentre in Italia alcune barriere, anche di tipo regolatorio, non ne consentono ancora un pieno sviluppo: spiccano la mancata rimborsabilità di queste terapie, segnalata come rilevante dal 60% delle aziende coinvolte nella ricerca – svolta in collaborazione con Confindustria Dispositivi Medici e Farmindustria -, e la scarsa chiarezza del percorso di validazione clinica necessario (61%).
Quest’ultima barriera è riconosciuta anche dal 41% dei medici specialisti, che faticano inoltre a vedere le differenze tra queste soluzioni e altre App per la salute (67%). Affinché questo nuovo ambito di innovazione possa affermarsi concretamente, sarà fondamentale sciogliere le incertezze legate al tema regolatorio e rendere maggiormente uniformi le opportunità offerte agli attori del settore nel contesto italiano a quelle degli altri Paesi.
 A completare il quadro, l’intervento di Fabio Faltoni, responsabile progetto Frontiere Digitali di Confindustria Dispositivi Medici: “Le problematiche per quanto ci riguarda non sono legate all’innovazione tecnologica, ma la sostenibilità in termini di bilancio e in particolare tengo a porre l’accento su un ostacolo culturale: non bisogna banalizzare il mondo del digitale, perché un cerotto o un dispositivo indossabile che rileva una serie di parametri è un elemento a forte innovazione”.
A completare il quadro, l’intervento di Fabio Faltoni, responsabile progetto Frontiere Digitali di Confindustria Dispositivi Medici: “Le problematiche per quanto ci riguarda non sono legate all’innovazione tecnologica, ma la sostenibilità in termini di bilancio e in particolare tengo a porre l’accento su un ostacolo culturale: non bisogna banalizzare il mondo del digitale, perché un cerotto o un dispositivo indossabile che rileva una serie di parametri è un elemento a forte innovazione”.
Tra i nodi da sciogliere, la normativa di riferimento che non è ritenuta ancora adeguata all’evoluzione dell’innovazione e il problema dell’accesso al mercato, che fa riferimento a inserimento nei Lea, alla modifica dei Piani diagnostico terapeutici, fondamentale per l’introduzione delle tecnologie nel processo clinico quotidiano, e infine quello dell’adeguamento degli strumenti di acquisto e gare: “Si va sempre di più nella direzione di mega gare Consip, di difficilissimo accesso per la piccola e media impresa che è la linfa vitale del Paese”.
In questo quadro si colloca il progetto Frontiere Digitali: “L’iniziativa nasce per fare rete e per cercare di dare una risposta positiva a un evento importante come il Piano Nazionale di Ripresa e Resilienza, opportunità che purtroppo in questo momento non si sta rivolgendo a capire come l’innovazione digitale possa modificare i processi e debba essere recepita in questi investimenti strutturali che vanno a modificare nel complesso il Servizio sanitario nazionale – ha detto -. Infine va citato il connubio importante tra scienza e industria, da sempre fattore propulsivo di tutti i processi di innovazione. Anche in questo momento serve un incentivo forte affinché le aziende investano in studi clinici e processi di ricerca e innovazione, superando l’attuale tendenza a demonizzare i rapporti fra mondo medico, della ricerca e dell’industria. Lacci e lacciuoli continuano a ostacolare l’industria”.
Luca Bollentini, #Educom, sottolinea come le aziende, soprattutto quelle più consolidate, devono cambiare approccio per innovare i propri prodotti e servizi, raccontando l’esperienza di Educom, anche rispetto allo sviluppo di App e #terapiedigitali #OLS22 pic.twitter.com/6oLC3TkNmj
— Osservatori Digital (@Osserv_Digital) July 12, 2022
Con l’intervento di Mauro Grigioni, direttore del Centro nazionale per le tecnologie innovative in sanità pubblica dell’Istituto Superiore di Sanità, si è tornati sul quadro normativo: “Il Gdpr non è un ostacolo, bensì una sfida per il ricercatore e per il progettista che deve ragionare in questi termini fin dall’inizio del progetto e auspichiamo che lo Spazio europeo dei dati sanitari vada a completare la cornice in tal senso”.
Le #TerapieDigitali in Italia non sono ancora una realtà, mentre lo sono in altri Paesi, soprattutto in Germania. Mauro Grigioni ci spiega cosa è possibile “importare” rispetto a queste esperienze e quale ruolo sta giocando l’@istsupsan in questo ambito #OLS22 pic.twitter.com/GVvZp4F9oG
— Osservatori Digital (@Osserv_Digital) July 12, 2022
 Stefania Marcoli, Service Design Lead di AstraZeneca, ha sottolineato come AstraZeneca Italia abbia trovato la propria sede da gennaio al Milano Innovation District – Mind: “Il posto giusto per progettare ricerca e innovazione”. A proposito di innovazione, ha commentato: “Non basta cavalcare i bisogni: bisogna guidare il futuro e mettere in pratica tutti insieme il futuro che vogliamo. Crediamo nella cross pollination tra diverse entità e fra pubblico e privato e i nostri progetti nascono per essere pratici e scalabili fin dall’inizio, perché l’innovazione non si può definire tale se non scala. Inoltre crediamo che la tecnologia da sola non sia sufficiente, se non è all’interno del disegno dei processi: non basta il digitale, bisogna capire quale sia l’impatto per il benessere delle persone e riprogrammare i percorsi di cura”.
Stefania Marcoli, Service Design Lead di AstraZeneca, ha sottolineato come AstraZeneca Italia abbia trovato la propria sede da gennaio al Milano Innovation District – Mind: “Il posto giusto per progettare ricerca e innovazione”. A proposito di innovazione, ha commentato: “Non basta cavalcare i bisogni: bisogna guidare il futuro e mettere in pratica tutti insieme il futuro che vogliamo. Crediamo nella cross pollination tra diverse entità e fra pubblico e privato e i nostri progetti nascono per essere pratici e scalabili fin dall’inizio, perché l’innovazione non si può definire tale se non scala. Inoltre crediamo che la tecnologia da sola non sia sufficiente, se non è all’interno del disegno dei processi: non basta il digitale, bisogna capire quale sia l’impatto per il benessere delle persone e riprogrammare i percorsi di cura”.
Elena Paola Lanati spiega qual è la visione di @AtmpForum rispetto alle opportunità che derivano dall’utilizzo delle #TerapieAvanzate e qual è la situazione dell’Italia rispetto ad altri Paesi Europei #OLS22 pic.twitter.com/9DtXVvyBan
— Osservatori Digital (@Osserv_Digital) July 12, 2022
Startup: i budget più alti per i Real World Data
A livello mondiale, le startup del life science hanno raccolto mediamente finanziamenti per 36,4 milioni di euro. Il 62% si occupa di realizzare prodotti innovativi, come dispositivi medici o farmaci, mentre la restante parte si focalizza sullo sviluppo di soluzioni per migliorare il processo di ricerca clinica. Analizzando questa seconda categoria, il 44% propone innovazioni alla fase di trial post-market, il 31% alla fase di discovery e ricerca preclinica, il 25% si occupa di innovare la fase di trial clinico. Le startup che hanno ottenuto finanziamenti più significativi si occupano di soluzioni in grado di raccogliere e sfruttare i Real World Data (77 milioni di dollari di finanziamento medio) e di Terapie Digitali (67 milioni), segno della grande fiducia che gli investitori stanno riponendo in queste soluzioni digitali, con particolare attenzione ai dati che consentiranno di raccogliere.
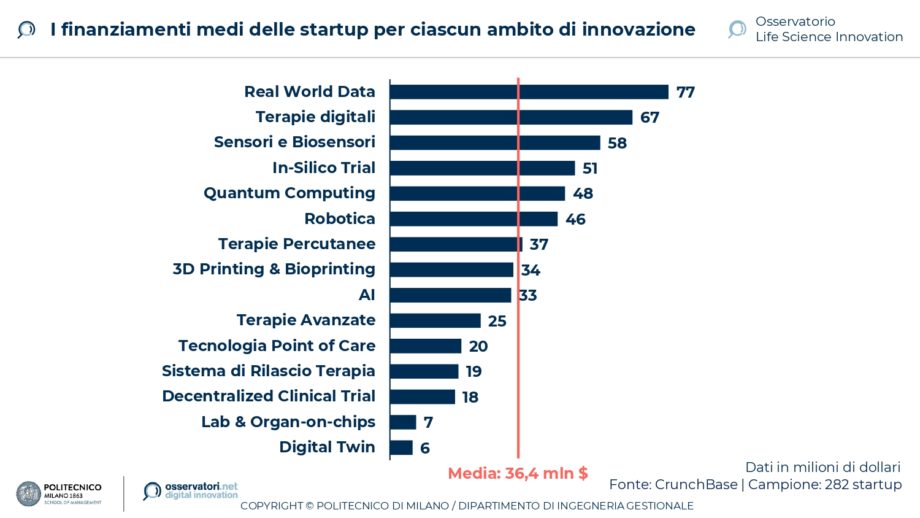
Ecco quindi gli ambiti più promettenti secondo la direttrice dell’Osservatorio Chiara Sgarbossa:
- Artificial Intelligence. Permette di accelerare diverse fasi della ricerca clinica e, in particolare, quella di discovery. è presente in altre soluzioni digitali che raccolgono dati sul paziente attraverso sensori o App
- Sensori o biosensori e Real World Data. Le startup offrono sensori soprattutto indossabili e impiantabili che permettono il monitoraggio e la raccolta di Real World Data che vengono poi sfruttati anche nell’ambito di Decentralized Clinic Trial
- Terapie Digitali. Rappresentano un approccio innovativo alla cura soprattutto nell’ambito delle patologie croniche, nei disturbi cognitivo-comportamentali e nella lotta alle dipendenze
- Terapie Avanzate. Sono particolarmente diffuse le startup che offrono terapie geniche in ambito oncologico e per trattare malattie rare





