L’antibiotico-resistenza (in inglese AntiMicrobial Resistance, AMR) è un’altra pandemia di cui si parla molto, ma si percepisce poco. Larry Kerr, della Transatlantic Task Force on Antimicrobial Resistance, ha paragonato l’AMR a tanti piccoli incendi sparsi per l’Europa che rimangono invisibili rispetto alla catastrofe Covid-19, ma i primi non sono meno pericolosi della seconda.
In Italia ogni anno muoiono circa 10.000 persone a causa di questo problema. In Europa 33 mila persone. Per questo siamo osservati speciali nel Vecchio Continente e l’altra pandemia, quella fin troppo percepita, da Covid-19 ha peggiorato la situazione sotto certi aspetti perché, soprattutto nelle prime fasi, si sono somministrati molti antibiotici credendo di avere di fronte non solo un’infezione virale, ma anche una seconda infezione batterica. Gli ultimi dati di AIFA sono eloquenti: l’azitromicina, usata come farmaco anti Covid, continua a registrare aumenti notevoli sia a livello territoriale sia ospedaliero.
L’antibiotico-resistenza in Italia potrebbe costare da qui al 2050 circa 11 miliardi di euro. Senza contare l’impatto sulle ospedalizzazioni e sulla gestione delle malattie croniche, perché la resistenza agli antibiotici può mettere a serio rischio soggetti fragili, anziani e persone con comorbidità, immunodepressi e anche chi ha contratto il virus Sars-Cov2.
AIFA, recentemente, ha organizzato un webinar proprio su questo argomento, intervistando Mike Sharland, esperto OMS per l’antibiotico-resistenza. Ciò che è emerso è una situazione complessa che non riguarda solo il nostro paese, ma tutto il mondo. Nicola Magrini, direttore AIFA e moderatore del webinar, ha esordito infatti parafrasando Oscar Wilde: “Per quanto riguarda l’AMR, la verità pura e semplice è una chimera, perché la verità non è mai pura e raramente è semplice”, concetto ancora più vero per questo problema di salute mondiale i cui confini non si riescono bene a delineare, i nuovi antibiotici non sembrano andare incontro ai reali bisogni sanitari e i governi paiono latitare in quanto a monitoraggi seri ed efficaci.
Che cos’è l’antibiotico-resistenza
Come suggerisce il nome, si tratta della resistenza da parte dei batteri agli antibiotici che dovrebbero distruggerli o perlomeno bloccarli.
Il problema ha cause diverse. Una di queste è sicuramente l’utilizzo non appropriato (o potremmo chiamarlo abuso) di questi farmaci anche quando non è opportuno prenderli.
Tra le altre cause vi sono:
- utilizzo improprio degli antibiotici anche nella veterinaria;
- l’impiego diffuso degli antibiotici in zootecnia e in agricoltura (soprattutto negli allevamenti intensivi);
- la diffusione delle infezioni ospedaliere causate da microrganismi antibiotico-resistenti (e il limitato controllo di queste infezioni);
- una maggiore diffusione dei ceppi resistenti dovuta a un aumento dei viaggi internazionali e dei flussi migratori.
L’AMR in Italia e nel mondo
L’Organizzazione Mondiale della Sanità ha istituito il programma di sorveglianza globale, GLASS (Global Antimicrobical Surveillance System), per monitorare e risolvere a livello globale l’antibiotico-resistenza. L’Unione Europea, dal canto suo, nel 2017 ha messo a punto il nuovo Piano d’azione per contrastare l’antibiotico-resistenza, basato su un approccio “One Health” che considera in modo integrato la salute dell’uomo, degli animali e dell’ambiente.
La gravità e diffusione di questo fenomeno hanno fatto attivare diversi sistemi di sorveglianza, basati sulla raccolta dei dati di laboratorio a livello locale o nazionale. Nel 2000 è stata creata una rete di sorveglianza europea che nel 2010 è diventata EARS-Net (European Antimicrobial Resisitance Surveillance Network), un network di reti nazionali che raccoglie i dati di antibiotico-resistenza di 30 Paesi europei.
In Italia a monitorare l’antibiotico-resistenza è l’Istituto Superiore di Sanità (ISS) che coordina un network nazionale di laboratori ospedalieri di microbiologia che hanno come obbiettivo quello di descrivere frequenza e trend di antibiotico-resistenza in un selezionato gruppo di batteri isolati da certe infezioni particolarmente rilevanti (batteri nel sangue o meningiti).
La gravità e la diffusione dell’AMR hanno fatto attivare diversi sistemi di sorveglianza
Le indicazioni dell’OMS sono state recepite in Italia nel Piano nazionale di contrasto all’antimicrobico-resistenza (PNCAR) 2017-2020, con obiettivi di sorveglianza, prevenzione, comunicazione, formazione e ricerca volti a contrastare il preoccupante fenomeno. Nel nostro paese, secondo i dati raccolti dall’Istituto Superiore di Sanità, la resistenza agli antibiotici è tra le più alte in Europa.
L’ISS pubblica regolarmente i nuovi dati della sorveglianza nazionale dell’antibiotico-resistenza AR-ISS e quelli della sorveglianza nazionale dedicata alle batteriemie causate da enterobatteri produttori di carbapenemasi (CPE), come le Enterobacteriaceae, famiglie di batteri che producono l’enzima carbapenemasi e per questo non sono più sensibili a una classe di antibiotici di ultima linea, i carbapenemi. Questo significa che l’unica opzione terapeutica utile è rappresentata da altri antibiotici che sono spesso tossici e non sempre efficaci.
Dai due Rapporti emerge che nel 2019 in Italia le percentuali di resistenza alle principali classi di antibiotici per gli 8 patogeni sotto sorveglianza (Staphylococcus aureus, Streptococcus pneumoniae, Enterococcus faecalis, Enterococcus faecium, Escherichia coli, Klebsiella pneumoniae, Pseudomonas aeruginosa e Acinetobacter species) si mantengono elevate e talvolta in aumento rispetto agli anni precedenti. Inoltre, gli oltre 2.400 casi diagnosticati e segnalati nel 2019 evidenziano la larga diffusione in Italia delle CPE, soprattutto in pazienti ospedalizzati.
Il consumo degli antibiotici in Italia
Secondo l’ultimo Rapporto AIFA, in Italia il consumo degli antibiotici nel 2019 è superiore alla media europea e l’impiego inappropriato di questi farmaci supera il 25% in tutte le condizioni cliniche studiate (influenza, raffreddore comune, laringotracheite, faringite e tonsillite, cistite non complicata), a eccezione della bronchite acuta. Tutti i tassi d’inappropriatezza d’uso degli antibiotici sono comunque in calo.
Le attitudini prescrittive dei medici e le differenze socio-demografiche e culturali dei diversi contesti geografici incidono in maniera significativa sui consumi e l’utilizzo più frequente di antibiotici nei mesi invernali è correlato con i picchi di sindromi influenzali osservati nei diversi anni: già questo da solo è indice di inappropriatezza perché le infezioni virali non si curano con gli antibiotici.
Fondamentale è misurare l’inappropriatezza e adottare misure per contrastarla
Sempre secondo il rapporto di AIFA, i dati confermano l’esistenza di altri fattori che causano un uso non sempre appropriato di questi farmaci. Gli antibiotici sono i medicinali più prescritti nella popolazione pediatrica. Un utilizzo così frequente è in parte dovuto all’elevata incidenza delle malattie infettive in questa fascia d’età, ma in parte si deve anche alla difficoltà a effettuare una diagnosi microbiologica dell’infezione e alle pressioni da parte dei genitori, che inducono spesso il pediatra a una scarsa aderenza alle linee guida esistenti.
Circa il 90% delle prescrizioni a carico del SSN proviene dai Medici di Medicina Generale e dai Pediatri di Libera Scelta. È quindi la Medicina Generale l’ambito su cui è importante agire per migliorarne l’appropriatezza prescrittiva. I consumi ospedalieri, pur rappresentando una parte minoritaria, meritano di essere attentamente monitorati, in considerazione del loro impatto sulle resistenze batteriche.
In termini di spesa, il consumo di antibiotici corrisponde all’1,5% dei consumi totali a carico del SSN.
Nel periodo 2016-2019 è stata registrata una riduzione dei consumi in assistenza convenzionata del 5,8%, valore che si discosta ancora dall’obiettivo del 10% auspicato del Piano Nazionale di Contrasto dell’Antimicrobico-resistenza.
“Pensare l’impensabile”
Il webinar organizzato da AIFA ha un titolo che chiarisce subito la portata della situazione “Pensare l’impensabile”. Provare cioè a capire come poter contrastare efficacemente quella che non si può neanche definire una vera patologia, ma una resistenza ai farmaci. Secondo Mike Sharland, relatore del webinar e membro dell’EML Antibiotic Working Group Chair in seno all’Organizzazione Mondiale della Sanità, nonché professore della St. George’s University di Londra, gli obbiettivi imposti dall’OMS nel tredicesimo programma generale (2019 – 2023), prevedono di usare gli antibiotici della lista Access almeno nel 60% dei casi. Secondo l’esperto, questi antibiotici devono essere diffusi anche nei paesi a basso reddito e possono aiutare a contrastare l’antibiotico-resistenza perché sono quelli al momento più efficaci in questo senso.
Ma cosa sono esattamente gli antibiotici Access?
L’OMS, proprio per provare a dare un perimetro all’antibiotico-resistenza, ha ideato, tramite il progetto AWaRe, una categorizzazione degli antibiotici più usati al mondo che illustra le opzioni antibiotiche per ciascuna sindrome, bilanciando i benefici, i danni e il potenziale di resistenza.
Il progetto AWaRe dell’OMS intende incentivare l’utilizzo dell’opzione antibiotica più appropriata
Nel 2017, l’OMS ha esaminato 21 sindromi infettive comuni e ha selezionato le opzioni antibiotiche di prima e seconda scelta più appropriate per ciascuna delle sindromi.
AWaRe suddivide gli antibiotici esistenti in tre gruppi (Access, Watch, Reserve), specificando quali utilizzare per le infezioni più comuni e ricorrenti, quali dovrebbero essere sempre disponibili in un sistema sanitario e quali dovrebbero essere utilizzati solo come ultima risorsa.
L’OMS ha inoltre lanciato la campagna Adopt AwaRe per stimolare l’uso di questo strumento da parte dei diversi governi.
Gli antibiotici presenti nel gruppo Access sono antibiotici a stretto spettro e quindi più sicuri ed efficaci, mentre le liste Watch e Reserve prevedono antimicrobici ad ampio spettro, che producono più facilmente resistenza. Inoltre, i farmaci Access sono anche meno costosi, perché esistono in formulazioni generiche.
Secondo Sharland, nel 60% delle 10 infezioni più comuni i sintomi si possono trattare senza l’uso di antibiotici, soprattutto se si tratta di infezioni lievi. Non solo, ma almeno metà delle persone che necessitano cure primarie in ospedale ricevono antibiotici, quando invece il target suggerito dall’OMS è del 30%.
Per l’esperto inglese i governi dovrebbero fare di più per monitorare la situazione e adottare studi più incisivi, e implementare siti o centri “sentinella” che monitorino con maggiore efficacia l’uso degli antibiotici. Il problema, infatti, non è la mancanza di linee guida, quelle ci sono. Ma di misurare in modo efficace l’inappropriatezza e adottare misure per contrastarla.
Nei paesi a basso reddito occorre lavorare per diffondere gli antibiotici in lista Access, ricorda Sharland, perché in queste nazioni, dal 2000 al 2015, si è assistito a un aumento dell’uso degli antibiotici Watch.
I nuovi antibiotici
Uno dei modi per contrastare l’antibiotico-resistenza è impiegare antibiotici innovativi. Ma su questo fronte lo stesso Sharland non si è mostrato troppo ottimista.
A livello di pipeline, EMA negli ultimi 5 anni ha approvato 11 nuovi antibiotici, altri 25 sono nelle fasi I/II/III e sono diretti contro i patogeni prioritari indicati dall’OMS. Metà di questi sono inibitori delle beta-lattamasi (enzimi prodotti da alcuni batteri e responsabili della loro resistenza agli antibiotici β-lattamici come le penicilline, le cefalosporine, i carbapenemi e i monobattami), pochi sono a uso orale (sono soprattutto iniettabili) e pochi sono focalizzati sulle beta-lattamasi a spettro esteso (Esbl). E non sono molti quelli davvero innovativi contro i batteri Gram-negativi (ad esempio la Klebsiella pneumoniae e l’Escherichia coli) che rappresentano in tutto il mondo una minaccia crescente alla salute delle persone, specie quelle più fragili, perché si diffondono rapidamente e producono forme resistenti alle terapie.
La disponibilità di antibiotici innovativi non sarà immediata
I farmaci in fase preclinica sembrano essere invece più promettenti, ma non arriveranno prima di dieci anni.
Secondo un articolo pubblicato su Nature, le principali sfide scientifiche, come la penetrazione e il rischio associato di tossicità (a causa delle dosi elevate richieste), necessitano di un forte programma di ricerca che non può essere portato avanti solo da piccole aziende, ma purtroppo in questo settore i grandi player del farma latitano.
Per Sharland, quindi, i nuovi antibiotici non vanno davvero incontro ai bisogni globali per contrastare l’antibiotico-resistenza (che comunque non è un fenomeno facile da definire e non esiste un’unica strategia che può risolvere la situazione).
Se non si interverrà in tempo, nei prossimi 30 anni l’AMR potrebbe causare 2,4 milioni di morti tra Europa, Nord America e Australia. In alcuni paesi a basso o medio reddito le infezioni causate dall’AMR sono tra il 40 e il 60%, mentre nei paesi più industrializzati questa percentuale si attesta mediamente al 17%.
AMR e Covid-19
Secondo una revisione sistematica pubblicata sulla rivista Clinical Microbiology and Infection, tra i pazienti Covid ospedalizzati, quelli che hanno presentato in questi mesi un’infezione batterica sono stati pochi (6,9%) a fronte però di un uso invece molto elevato di antibiotici, che in molti casi sono usati in modo empirico, vale a dire ancora prima di individuare l’infezione batterica. In via preventiva, per intenderci.
Nel corso della prima ondata si è verificato un abuso di antibiotici, perché non era chiaro se l’infezione da Covid, di tipo virale, si presentasse assieme a un’infezione batterica, eventualità che poi si è scoperto essere piuttosto rara (ma lo sappiamo adesso).
Lo sviluppo di sovra infezioni può insorgere nel caso di degenze prolungate, se viene inserito un catetere venoso o urinario, o nelle procedure di intubazione che facilitano l’ingresso di microrganismi. L’ospedale, in questo senso, può essere un incubatore di batteri resistenti.
In Italia occorre lavorare ancora molto sulla prevenzione della resistenza agli antibiotici e sull’utilizzo di tamponi e antibiogrammi per selezionare il farmaco più appropriato.
Usarne uno ad ampio spettro è più facile, evidentemente. Perché a ben vedere gli ultimi dati AIFA sull’uso dei medicinali in ambito Covid, l’azitromicina, che secondo AwaRe è nella lista Watch e quindi non dovrebbe essere usato se non per casi specifici, ha avuto un’impennata nel 2020 rispetto al 2019 e il 2021 è iniziato in crescita.
Sebbene AIFA non ne abbia mai approvato l’uso per COVID-19, l’azitromicina continua a registrare aumenti notevoli sia a livello territoriale sia ospedaliero, in particolar modo in Campania (+250%) e Lazio (+300%).
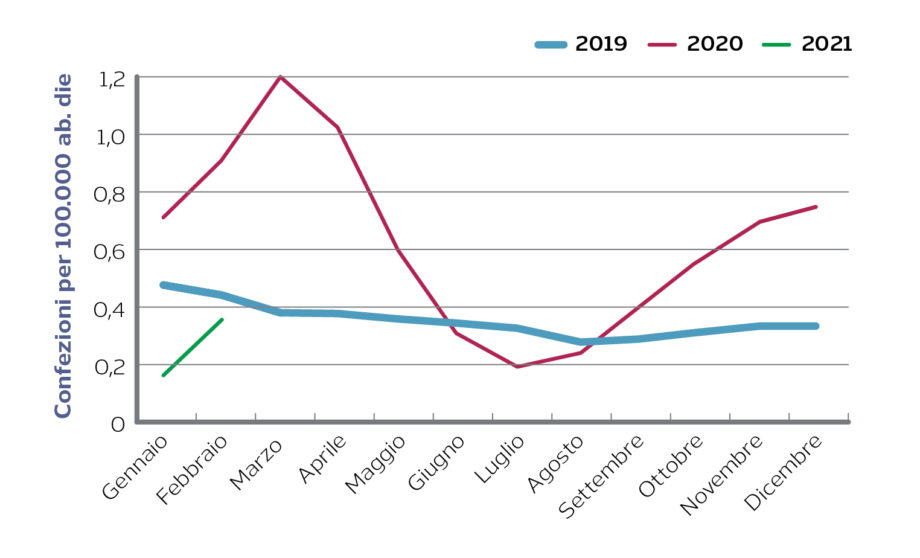
Azitromicina: confezioni acquistate dalle strutture SSN (ospedali, Asl,…) in Italia
Fonte: Monitoraggio AIFA sull’uso dei farmaci durante l’epidemia Covid-19
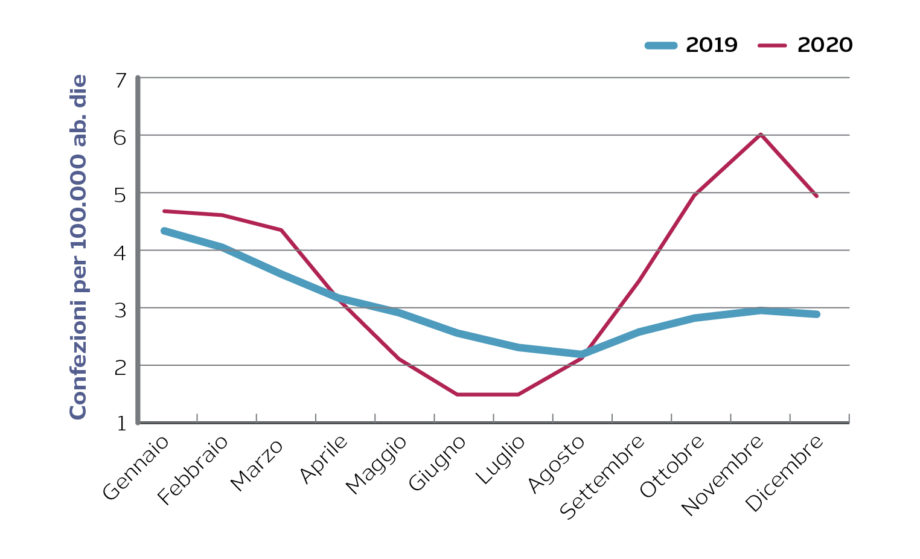
Azitromicina: confezioni acquistate dalle farmacie territoriali in Italia
Fonte: Monitoraggio AIFA sull’uso dei farmaci durante l’epidemia Covid-19







