La Real World Evidence (RWE) è l’evidenza generata dall’elaborazione dei dati sugli effetti dei farmaci dopo l’immissione in commercio. Descritta così, pare una semplice analisi a posteriori di farmacovigilanza, ma la realtà è ben diversa.
Se è vero da un lato che il gold standard per stabilire l’efficacia di un trattamento è rappresentato dal trial clinico randomizzato, d’altro canto i suoi risultati non sono estendibili a livello universale. Infatti, solo i dati della Real World Evidence, cioè della pratica clinica, le evidenze prodotte nel mondo reale, in corsia, giorno dopo giorno, potranno confermare o meno la validità di quei risultati.
La RWE può rappresentare l’evoluzione della medicina personalizzata, ottimizzare la spesa farmaceutica ed essere un innovativo strumento di governance sanitaria
Se usata in modo standard, coerente e rigoroso, la RWE può rappresentare l’evoluzione della medicina personalizzata, può ottimizzare la spesa farmaceutica e può essere un innovativo strumento di governance sanitaria. Può aiutare a migliorare e implementare le conoscenze sulle prestazioni mediche, per generare nuove evidenze e rispondere a esigenze cliniche irrisolte.
Un risultato che si può raggiungere solo se si usano in modo sapiente le tecnologie e si creano ecosistemi tra aziende sanitarie (pubbliche e private), aziende farmaceutiche ed enti governativi.
Ne abbiamo parlato in una Live dedicata insieme a Gianluca Trifirò, Professore Ordinario di Farmacologia, Dipartimento di Diagnostica e Sanità Pubblica, Università degli Studi di Verona, ed Eliana Ferroni del Servizio Epidemiologico Regionale (SER) dell’Azienda Zero, Regione Veneto.
Durante la diretta abbiamo pubblicato i risultati dei sondaggi condotti sulla nostra pagina Linkedin per capire cosa ne pensano i nostri follower del tema proposto. Ve li riproponiamo.

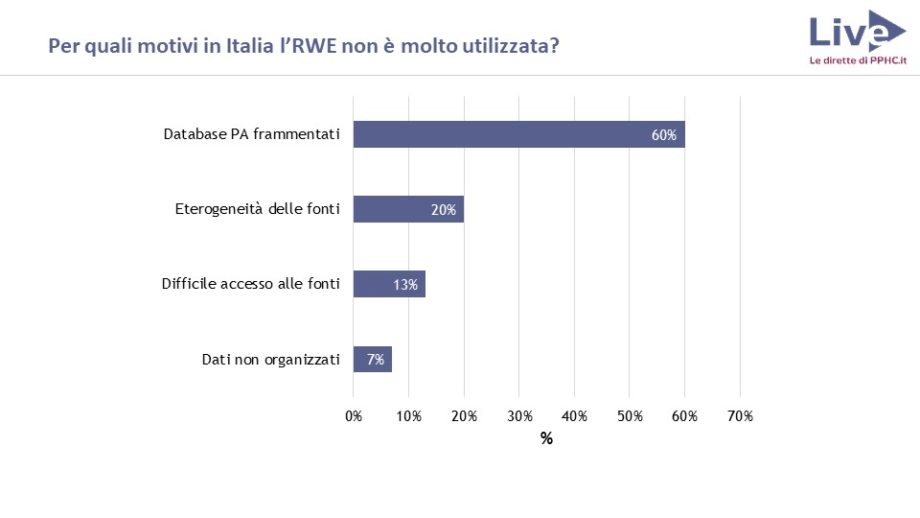
Che cosa si intende esattamente per Real World Evidence (RWE)
I Real world data (RWD) sono i dati relativi allo stato di salute dei pazienti oppure ai servizi erogati e sono di solito raccolti nelle cartelle cliniche elettroniche e in vari database delle strutture sanitarie. Possono riguardare le ospedalizzazioni, le prescrizioni dei farmaci e le prestazioni sanitarie. La Real World Evidence è, come suggerisce il termine, un’evidenza clinica sull’uso, sui benefici e sui rischi di un determinato farmaco, ed è basata sui Real World Data.
Qualunque sia lo studio che si va a condurre, trial clinico o osservazionale, l’obiettivo è quello di generare evidenze sul rapporto rischi/benefici dei farmaci, sulla loro efficacia e appropriatezza prescrittiva.
“Gli studi sono un continuum – ha affermato il professor Trifirò – un percorso unico che va dall’inizio dell’analisi del dossier del farmaco da parte delle agenzie regolatorie, fino alla fase di post marketing. Quello che cambia sono gli strumenti utilizzati: nel trial clinico ci sono degli standard per valutare l’efficacia delle terapie; mentre per monitorare la sicurezza a lungo termine non si può prescindere da studi di real world, che sono diversi sia nelle modalità sia nelle fonti da utilizzare. Di fatto la RWE va a integrare le evidenze che sono già state accumulate nel setting premarketing dallo studio clinico”.
La RWE integra le evidenze già accumulate nel setting premarketing dallo studio clinico
Tra le fonti utilizzabili per la Real World Evidence ci sono i registri dell’Aifa, le banche dati amministrative, le banche dati di medicina generale, la segnalazione spontanea di reazioni avverse.
Inoltre, le App degli smartphone e altri digital device potrebbero aiutare a raccogliere informazioni anche sul Patient reported outcome (un’indicazione di esito clinico riportata direttamente dal paziente senza l’interpretazione da parte del medico o di qualsiasi altra figura professionale).
“Per l’approvazione all’immissione in commercio – continua il docente – è fondamentale condurre gli studi sperimentali, è altrettanto fondamentale, però, continuare a integrare le evidenze con gli studi di real world, grazie all’enorme mole di dati a disposizione e all’expertise dei numerosi gruppi di lavoro, anche istituzionali, presenti in Italia”.
Real World Evidence ed epidemiologia
L’epidemiologia studia l’incidenza di malattie e disturbi nella popolazione generale, la Real World Evidence ci restituisce invece le informazioni sugli effetti dei farmaci, dedotte dalla pratica clinica. Sono entrambe molto importanti e insieme possono fornire un quadro più esaustivo sulla penetrazione e il trattamento di una patologia.
“Lavorando nel servizio epidemiologico regionale – ha spiegato la dottoressa Ferroni – si ha accesso a database amministrativi regionali, con dati sanitari correnti molto preziosi, da cui è possibile ricavare delle evidenze importanti anche per la pratica clinica. Infatti, molti dei quesiti di ricerca sono posti dai clinici che chiedono conferma di alcune evidenze che riscontrano nella propria attività e che necessitano di essere comprovate su vasta scala, anche per meglio indirizzare la loro pratica clinica”.
I flussi di dati amministrativi-sanitari, quali quello ospedaliero, dei farmaci, delle esenzioni, consentono di fare un monitoraggio dello stato di salute della popolazione, controllare l’aderenza e la persistenza alla terapia e fare una valutazione sul campo dell’efficacia e della sicurezza delle terapie farmacologiche, avvalorando quei risultati già visti nei trial clinici.
L’impatto dei Real World Data è fondamentale quindi nella programmazione sanitaria e per dare risposte dove servono. In Italia ci sono tanti gruppi di lavoro che stanno andando in questa direzione: alcuni si sono formati spontaneamente per un interesse alla ricerca, altri sono nati sulla base di progetti finanziati a livello nazionale.
“Parlando di Covid – riprende la Ferroni – uno dei network più importanti per far fronte all’emergenza sanitaria è la rete ITA-COVID19, nata dalla collaborazione tra Istituto Superiore di sanità e alcune Regioni, che ha permesso di dare risposta a questioni fondamentali, in tempi rapidi”.
L’impatto dei Real World Data è fondamentale nella programmazione sanitaria e per dare risposte dove servono
La Real World Evidence potrebbe inoltre aiutare a integrare le informazioni sulla popolazione normalmente esclusa dai trial clinici (anziani, bambini, donne in gravidanza), soggetti su cui non si hanno dati robusti sull’efficacia dei medicinali, se non dopo la loro immissione in commercio.
“In una popolazione anziana come la nostra – riprende l’epidemiologa – c’è una grandissima variabilità nella casistica dovuta a comorbidità e anche al fatto che gli anziani spesso assumono farmaci diversi; soltanto analizzando la realtà si può capire l’efficacia e l’interazione dei diversi medicinali. Anche le donne, in generale, sono poco rappresentate nei trial clinici, è quindi possibile che nell’uso reale si presentino maggiori effetti collaterali rispetto a quelli evidenziati in fase sperimentale. Ad esempio, uno studio sui farmaci anticoagulanti orali ha rilevato come nelle donne si verifichino maggiormente casi di palpitazione atriale”.
Anche nel caso dei vaccini si sono verificate più reazioni avverse nelle donne; questo suggerisce che bisognerebbe considerare già nello studio clinico una quota femminile più importante per identificare fin da subito le possibili problematiche.
La Real World Evidence può rafforzare la farmacovigilanza
In questi tempi di pandemia abbiamo visto quanto sia importante poter contare su terapie efficaci ma in tempi brevi. Di solito ci vogliono anni per consolidare l’efficacia di un farmaco in post marketing, ma con l’emergenza sanitaria i tempi si sono dovuti per forza accorciare.
“Ci sono degli strumenti consolidati da parte delle agenzie regolatorie – ha sottolineato Trifirò – che permettono di trovare il giusto compromesso tra l’urgenza di immettere sul mercato delle terapie di grande importanza (come ad esempio quelle salvavita, laddove non ci sono alternative terapeutiche) e la completezza e la robustezza dei dati sul profilo rischi/benefici. Uno di questi strumenti è il conditional approval dell’EMA, l’agenzia europea per i farmaci, che permette di accelerare l’immissione di farmaci o vaccini, come è accaduto con la COVID-19, concordando un set di dati aggiuntivi da real world evidence che andranno a integrare le evidenze già accumulate con gli studi premarketing”.
Quando c’è necessità di accelerare i tempi viene massimizzata l’importanza della RWE che diventa parte integrante del processo autorizzativo. Ci sono dei criteri ben definiti per questo tipo di procedura, che si attua in caso di urgenza o di mancanza di alternative terapeutiche.
Quando bisogna accelerare i tempi, viene massimizzata l’importanza della RWE che diventa parte integrante del processo autorizzativo
Il conditional approval è quindi un’approvazione condizionata all’integrazione successiva di dati che possano irrobustire le evidenze che hanno portato all’approvazione. Ma questo non significa che la sperimentazione sia ancora in corso. La sperimentazione finisce quando l’azienda che l’ha portata avanti raccoglie tutti i dati e presenta all’ente regolatorio la richiesta di ottenere questa approvazione. Una volta ottenuta, il farmaco si immette in commercio con la condizione di inviare dati di real world evidence all’ente regolatorio per confermarne la validità. Siamo quindi in una fase post marketing. Per fare un esempio: i vaccini anti-Covid che stiamo usando per l’attuale campagna vaccinale sono stati tutti approvati con il conditional approval dell’EMA.
La RWE potrebbe aiutare a ottimizzare i costi del SSN
L’uso della RWE è funzionale per diversi obiettivi, tra cui quello del risparmio economico. Avere accesso ai database per capire quali servizi siano stati erogati, o a quanti pazienti siano stati prescritti certi farmaci, consente di fare valutazioni sull’impatto delle terapie e sui costi associati alle stesse.
“Il punto però – riprende Trifirò – è che non bisogna compartimentare le voci di costo, come accade nella reportistica ASL, dove si guardano in modo superficiale i dati. Servono indicatori specifici per ciascun caso per estrarre dei dati efficaci e poter generare risparmio. Il che significa che magari cresce il costo della spesa farmacologica, a fronte però di una riduzione complessiva del costo di gestione del paziente, perché, ad esempio, diminuisce la necessità di ospedalizzazione”.
Per generare risparmio servono indicatori specifici e bisogna non compartimentare le voci di costo
Da un punto di vista operativo è un processo complesso, perché ciascun direttore sanitario è chiamato a rispondere della propria spesa e si finisce a misurare la spesa farmaceutica senza tenere conto dell’impatto che genera su altri fronti. Servirebbe un lavoro condiviso da parte di ASL, Regioni, specialisti e medici di famiglia, affinché lavorino insieme per un progetto di autovalutazione e per l’efficientamento del SSN.
“L’ultimo scoglio da superare in Italia per un massiccio utilizzo della RWE è la formazione del personale – ribadisce – perché l’accesso ai dati da parte di gruppi non qualificati può generare evidenze sbagliate”.
La parte più delicata di tutto il processo: la raccolta e la qualità del dato
Di dati ne abbiamo in quantità industriale. Il punto è capire che informazioni rappresentino.
Occorre lavorare sulla qualità, perché in alcune situazioni il dato è solido, mentre in altre è frammentato e incompleto. A volte i dati sono riportati in modo diverso da ospedale a ospedale, rendendo impossibile un confronto. “Bisogna responsabilizzare chi li inserisce – rimarca la dottoressa Ferroni – ad esempio con programmi di audit”.
Tutti i farmaci, indipendentemente dal canale prescrittivo e distributivo, dovrebbero poter essere tracciati. Ma nella realtà non è così: quelli senza prescrizione o quelli erogati nelle case di riposo rimangono fuori dai flussi di tracciamento, impedendo quindi lo studio dell’efficacia su quella fascia di popolazione.
“Gli strumenti di inserimento dei dati possono sempre essere migliorati – riprende la dottoressa Ferroni – soprattutto nell’ottica di ridurre i dati mancanti. Serve molta formazione per gli addetti ai lavori, in modo che passi il concetto dell’importanza dei dati che si inseriscono, e si migliorino di conseguenza i flussi. Non serve una supervisione dall’alto”.
I farmaci senza prescrizione e quelli erogati nelle case di riposo non vengono tracciati nei flussi di tracciamento
Il controllo del dato è sempre fondamentale per far sì che le informazioni chiave siano corrette e complete.
E che dire dei dati che provengono dalle app e dai dispositivi indossabili che monitorano i nostri parametri: sono affidabili?
“Credo siano strumenti di grande interesse – ammette Trifirò – danno informazioni sulla qualità della vita dei pazienti e in alcune condizioni particolari, come le malattie rare, possono essere molto utili. Bisogna però definire un contesto istituzionale e regolatorio in cui queste informazioni possano essere valorizzate, perché si genera altrimenti una giungla di fonti di dati, dall’attendibilità non chiara”.
Viene da chiedersi se i fondi del PNRR che stanno per arrivare potranno essere usati anche per migliorare la tracciabilità e la lettura dei dati e, soprattutto, per avere un sistema completamente digitalizzato, interoperabile e interrogabile in modo semplice e intuitivo. In modo che la RWE sia davvero utile ed efficace, sia sul fronte clinico, sia su quello della sostenibilità del SSN.




